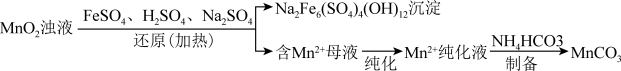解答题-工业流程题 适中0.65 引用1 组卷157
MnCO3是重要化工原料,由MnO2制备MnCO3一种工艺流程如图:
I.研磨MnO2,加水配成浊液。
II.MnO2浊液经还原、纯化、制备等过程,最终获得MnCO3固体。
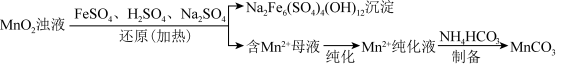
资料:
①MnCO3不溶于水。该工艺条件下,MnO2与H2SO4不反应。
②难溶电解质的溶度积:Ksp[Fe(OH)3]=2.8×10-39、Ksp[Mn(OH)3]=2.0×10-13
(1)研磨MnO2的目的是____ 。
(2)加入铁粉除去FeSO4溶液中的Fe3+,反应的离子方程式是____ 。
(3)MnO2氧化Fe2+的反应如下:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O
①根据上述反应,还原MnO2所需的H+与Fe2+的物质的量比值应为2。而实际上加入的酸要少一些,请结合含铁产物解释原因____ 。
②取少量母液,滴加K3[Fe(CN)6]溶液,未产生蓝色沉淀,说明____ 。
(4)纯化向母液中滴加氨水调pH,除去残留的Fe3+。若母液中c(Mn2+)=1mol•L-1,使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5mol•L-1,此时是否有Mn(OH)2沉淀生成?____ (列式计算,已知 ≈6.5)。
≈6.5)。
(5)制备将Mn2+纯化液与稍过量的NH4HCO3溶液混合,得到含MnCO3的浊液。将浊液过滤,洗涤沉淀,干燥后得到MnCO3固体。
①通过检验SO 来判断沉淀是否洗涤干净。检验SO
来判断沉淀是否洗涤干净。检验SO 的操作是
的操作是____ 。
②生成MnCO3的离子方程式是____ 。
I.研磨MnO2,加水配成浊液。
II.MnO2浊液经还原、纯化、制备等过程,最终获得MnCO3固体。
资料:
①MnCO3不溶于水。该工艺条件下,MnO2与H2SO4不反应。
②难溶电解质的溶度积:Ksp[Fe(OH)3]=2.8×10-39、Ksp[Mn(OH)3]=2.0×10-13
(1)研磨MnO2的目的是
(2)加入铁粉除去FeSO4溶液中的Fe3+,反应的离子方程式是
(3)MnO2氧化Fe2+的反应如下:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O
①根据上述反应,还原MnO2所需的H+与Fe2+的物质的量比值应为2。而实际上加入的酸要少一些,请结合含铁产物解释原因
②取少量母液,滴加K3[Fe(CN)6]溶液,未产生蓝色沉淀,说明
(4)纯化向母液中滴加氨水调pH,除去残留的Fe3+。若母液中c(Mn2+)=1mol•L-1,使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5mol•L-1,此时是否有Mn(OH)2沉淀生成?
(5)制备将Mn2+纯化液与稍过量的NH4HCO3溶液混合,得到含MnCO3的浊液。将浊液过滤,洗涤沉淀,干燥后得到MnCO3固体。
①通过检验SO
②生成MnCO3的离子方程式是
22-23高三上·北京西城·期中
类题推荐
MnO2是重要化工原料,由软锰矿制备MnO2的一种工艺流程如下:

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
③该工艺条件下,MnO2与H2SO4不反应。
(1)溶出
①溶出前,软锰矿需研磨,目的是___________ 。
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:
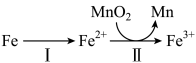
i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是___________ 。
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是___________ 。
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:___________ 。
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为___________ 。
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为___________ (用质量分数表示)。[已知:MnO2及 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
| Fe3+ | A13+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出
①溶出前,软锰矿需研磨,目的是
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:

i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为
MnO2是重要的化工原料,由软锰矿(主要成分为MnO2,主要杂质有Al2O3和SiO2)制备MnO2的一种工艺流程如图:
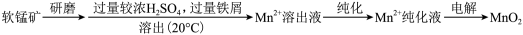
资料:①该工艺条件下MnO2与H2SO4不反应。
②部分金属阳离子沉淀的pH(25℃)。
(1)“溶出”前,软锰矿需要进行研磨的目的___ 。
(2)“溶出”时,Fe的氧化过程及得到Mn2+的主要途径如图所示。
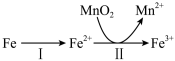
①Ⅱ是从软锰矿石中溶出Mn2+的主要反应,反应的离子方程式是___ 。
②若Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2。而实际比值约0.9小于2,原因是___ 。
(3)“纯化”时,先向溶出液中先加入MnO2,将溶液中Fe2+氧化;再加入NH3•H2O调节溶液pH,使Fe3+、Al3+转化为氢氧化物沉淀而除去。适宜调节的pH范围是___ 。
(4)“纯化”后,过滤所得的滤渣中含有Al(OH)3和Fe(OH)3,实验室欲以该滤渣为原料制备少量Al2O3,实验操作为:取少量滤渣放入烧杯中,___ ,洗涤,灼烧沉淀得到Al2O3。(须使用的试剂:6mol•L-1NaOH溶液、干冰)
(5)向4.350g所得MnO2产品中依次加入足量6.700gNa2C2O4和足量稀H2SO4,加热至充分反应,再用0.02000mol•L-1KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为20.00mL。计算该产品中MnO2的纯度___ (杂质不参加反应,写出计算过程)。
已知过程中发生的反应为:MnO2+C2O +4H+→Mn2++CO2↑+H2O(未配平)、C2O
+4H+→Mn2++CO2↑+H2O(未配平)、C2O +MnO
+MnO +H+→Mn2++CO2↑+H2O(未配平)
+H+→Mn2++CO2↑+H2O(未配平)
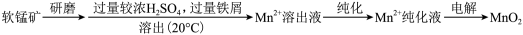
资料:①该工艺条件下MnO2与H2SO4不反应。
②部分金属阳离子沉淀的pH(25℃)。
| Fe3+ | Al3+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)“溶出”前,软锰矿需要进行研磨的目的
(2)“溶出”时,Fe的氧化过程及得到Mn2+的主要途径如图所示。

①Ⅱ是从软锰矿石中溶出Mn2+的主要反应,反应的离子方程式是
②若Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2。而实际比值约0.9小于2,原因是
(3)“纯化”时,先向溶出液中先加入MnO2,将溶液中Fe2+氧化;再加入NH3•H2O调节溶液pH,使Fe3+、Al3+转化为氢氧化物沉淀而除去。适宜调节的pH范围是
(4)“纯化”后,过滤所得的滤渣中含有Al(OH)3和Fe(OH)3,实验室欲以该滤渣为原料制备少量Al2O3,实验操作为:取少量滤渣放入烧杯中,
(5)向4.350g所得MnO2产品中依次加入足量6.700gNa2C2O4和足量稀H2SO4,加热至充分反应,再用0.02000mol•L-1KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为20.00mL。计算该产品中MnO2的纯度
已知过程中发生的反应为:MnO2+C2O
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网