解答题-原理综合题 适中0.65 引用2 组卷180
捕集 的技术对解决全球温室效应意义重大。回答下列问题。
的技术对解决全球温室效应意义重大。回答下列问题。
(1)国际空间站处理 的一个重要方法是将
的一个重要方法是将 还原,所涉及的反应方程式为:
还原,所涉及的反应方程式为:

 几种化学键的键能如表所示:
几种化学键的键能如表所示:
则
______ 。
(2)将 还原为
还原为 ,是实现
,是实现 资源化利用的有效途径之一。装置如图所示:
资源化利用的有效途径之一。装置如图所示:
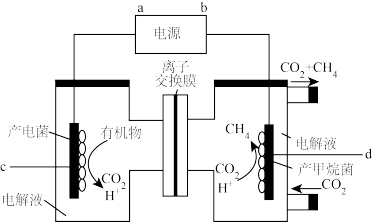
① 的移动方向为
的移动方向为______ (填“自左至右”或“自右至左”);d电极的电极反应式为____________ 。
②若电源为 清洁燃料电池,当消耗0.1mol燃料
清洁燃料电池,当消耗0.1mol燃料 时,离子交换膜中通过
时,离子交换膜中通过______ mol ,该清洁燃料电池中的正极反应式为
,该清洁燃料电池中的正极反应式为____________ 。
(3)CaO可在较高温度下捕集 。
。 热分解可制备CaO,
热分解可制备CaO, 加热升温过程中固体的质量变化如图。
加热升温过程中固体的质量变化如图。
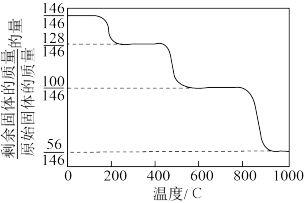
则400~600℃时分解得到的气体产物是______ (填化学式),写出800∼1000℃范围内分解反应的化学方程式:__________________________________________ 。
(1)国际空间站处理
化学键 | ||||
键能/kJ⋅mol | 413 | 436 | a | 745 |
(2)将

①
②若电源为
(3)CaO可在较高温度下捕集

则400~600℃时分解得到的气体产物是
22-23高三上·山东德州·期中
类题推荐
捕集 的技术对解决全球温室效应意义重大。回答下列问题:
的技术对解决全球温室效应意义重大。回答下列问题:
(1)国际空间站处理 的一个重要方法是将
的一个重要方法是将 还原,所涉及的反应方程式为:
还原,所涉及的反应方程式为: 几种化学键的键能如表所示:
几种化学键的键能如表所示:
则a=______ 。
(2)将 还原为
还原为 ,是实现
,是实现 资源化利用的有效途径之一,装置如图所示:
资源化利用的有效途径之一,装置如图所示:
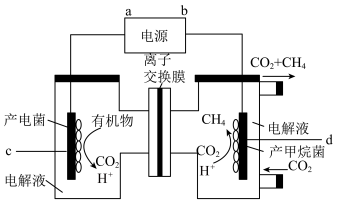
① 的移动方向为
的移动方向为______ (填“自左至右”或“自右至左”);d电极的电极反应式为______ 。
②若电源为 清洁燃料电池,当消耗
清洁燃料电池,当消耗 燃料
燃料 时,离子交换膜中通过
时,离子交换膜中通过______  ,该清洁燃料电池中的正极反应式为
,该清洁燃料电池中的正极反应式为______ 。
(3)甲醇是一种可再生能源,由 制备甲醇的过程可能涉及的反应如下:
制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
①反应Ⅱ的
______  。
。
②若反应Ⅱ在一恒温恒容密闭容器中进行,下面能说明反应已达到平衡状态的是______ 。
a. 断裂的同时有
断裂的同时有 断裂
断裂
b.气体密度不变
c.平衡常数不变
d.容器内 保持不变
保持不变
(1)国际空间站处理
化学键 | ||||
键能/ | 413 | 436 | a | 745 |
(2)将

①
②若电源为
(3)甲醇是一种可再生能源,由
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
①反应Ⅱ的
②若反应Ⅱ在一恒温恒容密闭容器中进行,下面能说明反应已达到平衡状态的是
a.
b.气体密度不变
c.平衡常数不变
d.容器内
国家主席习近平在9月22日召开的联合国大会上表示:“中国将争取在2060年前实现碳中和”。捕集CO2的技术对解决全球温室效应意义重大。回答下列问题:
(1)国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-270kJ·mol-1。几种化学键的键能如表所示:
则a=___________ 。
(2)将CO2还原为CH4,是实现CO2资源化利用的有效途径之一,装置如图所示:
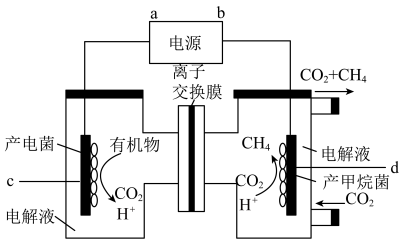
①H+的移动方向为___________ (填“自左至右”或“自右至左”);d电极的电极反应式为___________ 。
②若电源为CH3OH O2
O2 KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过
KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过___________ molH+,该清洁燃料电池中的正极反应式为___________ 。
(3)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应III:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.77kJ·mol-1
反应II的ΔH2=___________ kJ·mol-1。
(4)利用太阳能光解Fe3O4,制备的FeO用于还原CO2合成炭黑,可实现资源的再利用。其转化关系如图2所示。过程II反应的化学方程式是___________ 。

(5)在酸性电解质溶液中,以太阳能电池作电源,惰性材料作电极,可将CO2转化为乙烯。实验装置如图所示。

①若电解过程中生成3.36L(标准状况下)O2,则电路中转移的电子至少为___________ mol。
②生成乙烯的电极反应式是___________ 。
(1)国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-270kJ·mol-1。几种化学键的键能如表所示:
| 化学键 | C | H | H | C |
| 键能/kJ·mol-1 | 413 | 436 | a | 745 |
(2)将CO2还原为CH4,是实现CO2资源化利用的有效途径之一,装置如图所示:

①H+的移动方向为
②若电源为CH3OH
(3)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应III:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.77kJ·mol-1
反应II的ΔH2=
(4)利用太阳能光解Fe3O4,制备的FeO用于还原CO2合成炭黑,可实现资源的再利用。其转化关系如图2所示。过程II反应的化学方程式是

(5)在酸性电解质溶液中,以太阳能电池作电源,惰性材料作电极,可将CO2转化为乙烯。实验装置如图所示。

①若电解过程中生成3.36L(标准状况下)O2,则电路中转移的电子至少为
②生成乙烯的电极反应式是
碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。
(1)已知:
 。该反应的熵变
。该反应的熵变
___________ 0(填“>”“<”“=”),该反应自发进行的条件是___________ (填“低温”“高温”或“任意温度”)。
(2)将 还原为
还原为 ,是实现
,是实现 资源化利用的有效途径之一,所涉及的反应方程式为:
资源化利用的有效途径之一,所涉及的反应方程式为:
 ,几种化学键的键能如表所示:
,几种化学键的键能如表所示:
则a=___________ 。
(3)利用电化学原理,将 还原为
还原为 ,装置如图所示:
,装置如图所示:
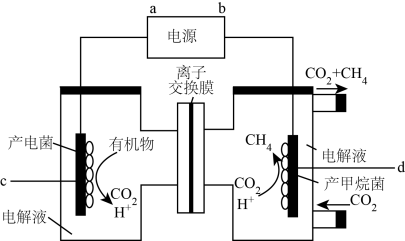
①d电极的电极反应式为___________ 。
②若电源采用 ―
― ―KOH清洁燃料电池,当消耗0.2mol燃料
―KOH清洁燃料电池,当消耗0.2mol燃料 时,离子交换膜中通过
时,离子交换膜中通过___________ mol ,该清洁燃料电池中的a极的电极反应式为
,该清洁燃料电池中的a极的电极反应式为___________ 。
(4)T℃时,向容积为2L的恒容密闭容器中通入3.0mol 和6.5mol
和6.5mol ,发生反应:
,发生反应:
 ,5分钟时反应达到平衡,
,5分钟时反应达到平衡, 的转化率为50%,回答下列问题:
的转化率为50%,回答下列问题:
①在0~5min内容器中
___________ 。
②该温度下上述反应的平衡常数
___________ 。
③下列措施能增大反应速率的是___________ (填字母)。
A.升高温度 B.扩大容器体积 C.充入一定量氦气 D.加入催化
(1)已知:
(2)将
| 化学键 | C―H | H―H | O―H | C=O |
| 键能/ | 414 | 436 | 464 | a |
(3)利用电化学原理,将

①d电极的电极反应式为
②若电源采用
(4)T℃时,向容积为2L的恒容密闭容器中通入3.0mol
①在0~5min内容器中
②该温度下上述反应的平衡常数
③下列措施能增大反应速率的是
A.升高温度 B.扩大容器体积 C.充入一定量氦气 D.加入催化
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


