解答题-原理综合题 适中0.65 引用3 组卷165
工业废气的排放对环境造成了极大的影响,研究其吸收或再利用对缓解环境污染有重要意义。请根据所学知识回答下列问题。
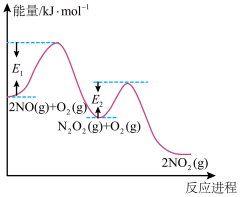
(1)工业废气中的H2S可用Fe2(SO4)3溶液吸收,反应后的溶液可在硫杆菌的作用下实现吸收液的再生。用Fe2(SO4)3吸收液脱除H2S经历以下三步:
I: ΔH<0
ΔH<0
II:
III:
①步骤I 在
在_______ (填“高温下”“低温下”或“任何条件下”)有利于自发进行。
②第II步的电离平衡常数的表达式为_______ 。
③反应后的溶液在硫杆菌的作用下进行的再生反应为 。该反应中每消耗标准状况下11.2LO2,可以再生出
。该反应中每消耗标准状况下11.2LO2,可以再生出_______ mol Fe2(SO4)3.该再生反应_______ (填“能”或“不能”)在高温下进行,理由是_______ 。
(2)CO2的大量排放会加剧温室效应,实现CO2的资源化利用不但能有效减少CO2排放,还可以变废为宝。CO2催化加氢合成二甲醚是一种CO2转化方法,转化过程中主要发生下列反应:
反应I: ΔH1=+41.2kJ·mol-1
ΔH1=+41.2kJ·mol-1
反应II: ΔH2=-122.5kJ·mol-1
ΔH2=-122.5kJ·mol-1
① ΔH3=
ΔH3=_______ kJ·mol-1
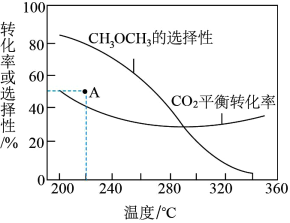
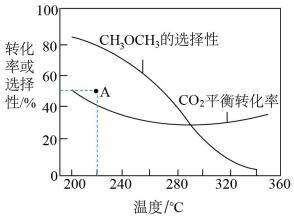
②在一压强为170kPa的恒压密闭容器中充入1molCO2和1mol H2发生反应I、II,CO2平衡转化率和平衡时CH3OCH3的选择性(CH3OCH3的选择性= ×100%)随温度的变化如图。
×100%)随温度的变化如图。
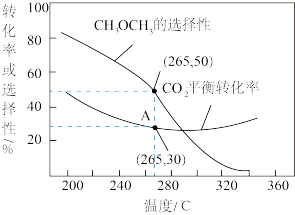
计算A点时H2(g)的转化率为_______ %,此温度下反应I的分压(分压=物质的量分数×总压)平衡常数Kp=_______ (保留一位有效数字)。
(1)工业废气中的H2S可用Fe2(SO4)3溶液吸收,反应后的溶液可在硫杆菌的作用下实现吸收液的再生。用Fe2(SO4)3吸收液脱除H2S经历以下三步:
I:
II:
III:
①步骤I
②第II步的电离平衡常数的表达式为
③反应后的溶液在硫杆菌的作用下进行的再生反应为
(2)CO2的大量排放会加剧温室效应,实现CO2的资源化利用不但能有效减少CO2排放,还可以变废为宝。CO2催化加氢合成二甲醚是一种CO2转化方法,转化过程中主要发生下列反应:
反应I:
反应II:
①
②在一压强为170kPa的恒压密闭容器中充入1molCO2和1mol H2发生反应I、II,CO2平衡转化率和平衡时CH3OCH3的选择性(CH3OCH3的选择性=

计算A点时H2(g)的转化率为
22-23高二上·广东广州·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网