解答题-原理综合题 适中0.65 引用1 组卷68
研究化学反应速率与平衡原理有助于学科思维的提升。
(1)已知焓变与熵变有如下关系:△G=ΔH-TΔS,某反应当△G<0时自发,△G>0不自发。今有A、B、C、D四个反应的焓变、熵变数据如下:
①在任何温度下都能自发进行的反应是_______ (选填ABCD序号,下同);
②任何温度下都不能自发进行的反应是_______ 。
(2)利用图所示装置,可测定盐酸与碳酸钙反应生成CO2的反应速率。请根据要求填空:
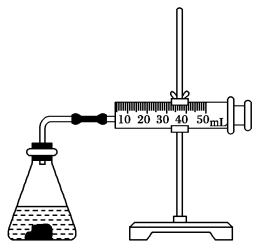
①连接仪器、检查装置气密后,在锥形瓶中加入5 g碳酸钙,迅速加入20 mL 1 mol·L-1盐酸,塞紧瓶塞。
②每隔10 s观测注射器中气体的体积,并以mL·s-1为反应速率的单位,计算每10 s内的反应速率。数据处理的结果见下表:
表格中的“?”处应填的数据是_______ ;从反应速率随时间变化的数据可知,本实验中反应速率与_______ 和_______ 有关。
(3)反应速率(v)和反应物浓度(c)的关系可以用实验方法测定。如化学反应 的正反应速率可表示为
的正反应速率可表示为 ,式中k为常数,a、b的值可用下表数据确定。据表中数据可推出a=
,式中k为常数,a、b的值可用下表数据确定。据表中数据可推出a=_______ 、b=_______ 。
(4)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),K为化学平衡常数,K和温度的关系如下表:
CO(g)+H2O(g),K为化学平衡常数,K和温度的关系如下表:
根据以上信息推断:
①该反应为_______ 热反应;
②达到平衡后,在其他条件不变情况下加入干燥剂无水氯化钙,氢气的转化率将_______ ;
③1000℃,某时刻CO2、H2、CO、H2O的物质的量分别为0.2mol、0.8mol、0.4mol、0.4mol,此时V正_______ V逆(填“>”、“<”或“=”)。
(5)在3种不同条件下,分别向容积为2 L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g)+B(g) 2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表。回答:
2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表。回答:
①K1、K2和K3三者的关系为_______ ;
②实验Ⅱ改变的条件可能是:_______ ;
③分别达平衡后,实验Ⅰ与实验Ⅲ容器内的压强大小关系是:Ⅰ_______ Ⅲ(选填“大于”、“小于”、“等于”);
④实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡将_______ (选填“朝正向移动”、“朝逆向移动”、“不移动”)。
(1)已知焓变与熵变有如下关系:△G=ΔH-TΔS,某反应当△G<0时自发,△G>0不自发。今有A、B、C、D四个反应的焓变、熵变数据如下:
| 反应 | A | B | C | D |
| ΔH/(kJ·mol-1) | 10.5 | 1.80 | -126 | -11.7 |
| ΔS/(J·mol-1·K-1) | 30.0 | -113.0 | 84.0 | -105.0 |
②任何温度下都不能自发进行的反应是
(2)利用图所示装置,可测定盐酸与碳酸钙反应生成CO2的反应速率。请根据要求填空:

①连接仪器、检查装置气密后,在锥形瓶中加入5 g碳酸钙,迅速加入20 mL 1 mol·L-1盐酸,塞紧瓶塞。
②每隔10 s观测注射器中气体的体积,并以mL·s-1为反应速率的单位,计算每10 s内的反应速率。数据处理的结果见下表:
| 时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
| 气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
| 反应速率/(mL·s-1) | 0.4 | 1.0 | 1.1 | ? | 0.9 | 0.8 |
(3)反应速率(v)和反应物浓度(c)的关系可以用实验方法测定。如化学反应
| c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | v/(mol·L-1·s-1) |
| 0.5 | 4.0 | 1.0k |
| 1.0 | 4.0 | 2.0k |
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应为
②达到平衡后,在其他条件不变情况下加入干燥剂无水氯化钙,氢气的转化率将
③1000℃,某时刻CO2、H2、CO、H2O的物质的量分别为0.2mol、0.8mol、0.4mol、0.4mol,此时V正
(5)在3种不同条件下,分别向容积为2 L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g)+B(g)
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 700 | 700 | 750 |
| 达平衡时间/min | 40 | 5 | 30 |
| n(D)平衡/mol | 1.5 | 1.5 | 1 |
| 化学平衡常数 | K1 | K2 | K3 |
②实验Ⅱ改变的条件可能是:
③分别达平衡后,实验Ⅰ与实验Ⅲ容器内的压强大小关系是:Ⅰ
④实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡将
22-23高二上·福建漳州·期中
类题推荐
课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g) + 3H2(g)  2NH3(g) △H<0,△S <0。
2NH3(g) △H<0,△S <0。
(1)下列关于工业合成氨的说法不正确的是_______
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的△H
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是_______
a 容器内N2、H2、NH3的浓度之比为1:3:2 b v(N2)正= v(H2)逆
c 容器内压强保持不变 d 合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如下:
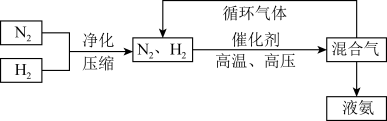
请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因_______ 。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。
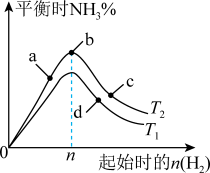
①图象中T2和T1的关系是:T2__________ T1(填“>,<或=”,下同)
②a、b、c、d四点所处的平衡状态中,反应物N2 的转化率最高的是______ (填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2mol H2和2mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
①此条件下该反应的化学平衡常数K=___________ 。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向_______ 反应方向移动(填“正”或“逆”)。
③N2(g)+3H2(g) 2NH3(g) △H= -92kJ/mol。在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为
2NH3(g) △H= -92kJ/mol。在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为______ mol。
(6)已知:N2(g)+3H2(g) 2NH3(g) △H= -92kJ/mol
2NH3(g) △H= -92kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式_________ 。
(1)下列关于工业合成氨的说法不正确的是
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的△H
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是
a 容器内N2、H2、NH3的浓度之比为1:3:2 b v(N2)正= v(H2)逆
c 容器内压强保持不变 d 合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如下:

请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图象中T2和T1的关系是:T2
②a、b、c、d四点所处的平衡状态中,反应物N2 的转化率最高的是
(5)恒温下,往一个4L的密闭容器中充入5.2mol H2和2mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向
③N2(g)+3H2(g)
(6)已知:N2(g)+3H2(g)
N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式
Ⅰ.已知:①C(石墨)+O2(g)=CO2(g)ΔH1=-393.5kJ/mol
②2H2(g)+O2(g)=2H2O(1)ΔH2=-571.6kJ/mol
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1)ΔH3=-2599.2kJ/mol
则由C(石墨)和H2(g)反应生成1molC2H2(g)的焓变ΔH=__ 。
Ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
回答下列问题:
(1)该反应为__ 反应(填“吸热”“放热”)。
(2)能 判断该反应已达化学平衡状态的依据是__ (填序号)。
a.容器中压强不变
b.混合气体中c(CO)不变
c.容器中气体平均摩尔质量不变
d.1molH-H键断裂的同时断裂2molH-O键
(3)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试通过计算判断此时的温度为__ ℃。
(4)在830℃温度下,某时刻测得c(CO2)=0.5mol/L,c(H2O)=0.5mol/L,c(CO)=1mol/L,c(H2)=1.5mol/L,则此时v(正)___ v(逆)(填“>”、“<”或“=”)
(5)在830℃温度下,向该平衡体系中再充入一定量的氢气,CO2的转化率__ (填“增大”、“减小”、“不变”)。相同条件的1L密闭容器中,充入lmolCO2、lmolH2和lmolH2O,则达到平衡时,混合物中CO2的物质的量分数可能是___ 。(填序号)
A.16.67% B.22.2% C.33.3% D.36.8%
Ⅲ.CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
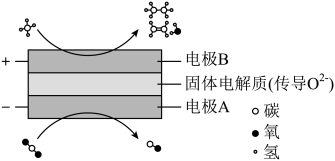
根据图示,写出阴极的反应式为___ 。
②2H2(g)+O2(g)=2H2O(1)ΔH2=-571.6kJ/mol
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1)ΔH3=-2599.2kJ/mol
则由C(石墨)和H2(g)反应生成1molC2H2(g)的焓变ΔH=
Ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
| T/°C | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为
(2)
a.容器中压强不变
b.混合气体中c(CO)不变
c.容器中气体平均摩尔质量不变
d.1molH-H键断裂的同时断裂2molH-O键
(3)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试通过计算判断此时的温度为
(4)在830℃温度下,某时刻测得c(CO2)=0.5mol/L,c(H2O)=0.5mol/L,c(CO)=1mol/L,c(H2)=1.5mol/L,则此时v(正)
(5)在830℃温度下,向该平衡体系中再充入一定量的氢气,CO2的转化率
A.16.67% B.22.2% C.33.3% D.36.8%
Ⅲ.CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:

根据图示,写出阴极的反应式为
课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g) + 3H2(g) 
 2NH3(g) △H<0,△S <0。
2NH3(g) △H<0,△S <0。
(1)下列关于工业合成氨的说法不正确的是_______
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的△H
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是_______
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v正(N2)= v逆(H2)
c.容器内压强保持不变 d.合气体的密度保持不变
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。
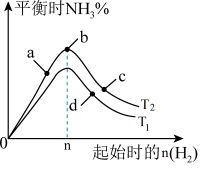
①图象中T2和T1的关系是:T2__________ T1(填“>,<或=”,下同)
②a、b、c、d四点所处的平衡状态中,反应物N2 的转化率最高的是______ (填字母)。
(4)恒温下,往一个4L的密闭容器中充入5.2mol H2和2mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
①此条件下该反应的化学平衡常数K=___________ 。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向_______ 反应方向移动(填“正”或“逆”)。
③N2(g)+3H2(g) 2NH3(g)△H= -92kJ/mol。在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为
2NH3(g)△H= -92kJ/mol。在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为______ mol。
(5)已知:N2(g)+3H2(g) 2NH3(g)△H= -92kJ/mol
2NH3(g)△H= -92kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式_________ 。
(1)下列关于工业合成氨的说法不正确的是
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的△H
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v正(N2)= v逆(H2)
c.容器内压强保持不变 d.合气体的密度保持不变
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图象中T2和T1的关系是:T2
②a、b、c、d四点所处的平衡状态中,反应物N2 的转化率最高的是
(4)恒温下,往一个4L的密闭容器中充入5.2mol H2和2mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向
③N2(g)+3H2(g)
(5)已知:N2(g)+3H2(g)
N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


