解答题-原理综合题 适中0.65 引用1 组卷27
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH1
Fe2O3(s)+ CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ CO2(g) ΔH2
CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH4
上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如图:
1600℃时固体物质的主要成分为_______ ,该温度下测得固体混合物中n(Fe):n(O)=5:1,则FeO被CO还原为Fe的百分率为 _______ (设其它固体杂质中不含Fe、O元素)。
(2)铁系金属常用作CO加氢反应的催化剂。已知某种催化剂可用来催化反应CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH<0。在T℃,压强为p时将1molCO和3molH2加入容积为1L的密闭容器中。实验测得CO的体积分数χ(CO)如表:
①前10min内,CO的平均反应速率υ(CO)=_______ (保留两位有效数字)。
②达到平衡时,体系的总压强p与初始压强之比p0,p:p0=_______ ;
③如图是该反应CO的平衡转化率与温度、压强的关系。
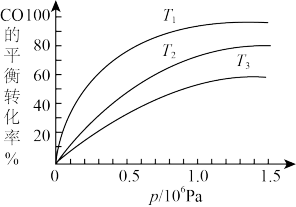
图中温度T1、T2、T3由高到低的顺序是_______ ,理由是 _______ ④45min时,保持容器的温度和体积不变,再加入1molCO和3molH2,再次达到平衡时,CO的平衡转化率 _______ (填“>”、“<”或“=”)30min时CO的平衡转化率。
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH1
Fe2O3(s)+
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH4
上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如图:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600℃时固体物质的主要成分为
(2)铁系金属常用作CO加氢反应的催化剂。已知某种催化剂可用来催化反应CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH<0。在T℃,压强为p时将1molCO和3molH2加入容积为1L的密闭容器中。实验测得CO的体积分数χ(CO)如表:
| t/min | 0 | 10 | 20 | 30 | 35 |
| χ(CO) | 0.25 | 0.20 | 0.17 | 0.15 | 0.15 |
①前10min内,CO的平均反应速率υ(CO)=
②达到平衡时,体系的总压强p与初始压强之比p0,p:p0=
③如图是该反应CO的平衡转化率与温度、压强的关系。

图中温度T1、T2、T3由高到低的顺序是
22-23高二上·山东临沂·阶段练习
类题推荐
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH1
Fe2O3(s)+ CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ CO2(g) ΔH2
CO2(g) ΔH2
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) ΔH3
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH4
则ΔH4的表达式为___________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)铁等金属可用作CO与氢气反应的催化剂。已知某种催化剂可用来催化反应CO(g)+3H2(g) CH4(g)+H2O(g) ΔH<0。在T℃、106Pa时将1molCO和3molH2加入容积可变的密闭容器中,实验测得CO的体积分数φ(CO)如下表:
CH4(g)+H2O(g) ΔH<0。在T℃、106Pa时将1molCO和3molH2加入容积可变的密闭容器中,实验测得CO的体积分数φ(CO)如下表:
①能判断反应CO(g)+3H2(g) CH4(g)+H2O(g)达到平衡的是
CH4(g)+H2O(g)达到平衡的是___________ (填字母)。
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为___________ ;在T℃、P0时该反应的压强平衡常数Kp=___________ (用简单分数表示,分压=总压×物质的量分数)
③某种含铁催化剂可以催化合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率、实际催化率和催化剂催化效率的影响如图所示,结合图象分析温度低于250℃时CO2实际转化率变化的原因:
CH2=CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率、实际催化率和催化剂催化效率的影响如图所示,结合图象分析温度低于250℃时CO2实际转化率变化的原因:___________ 。
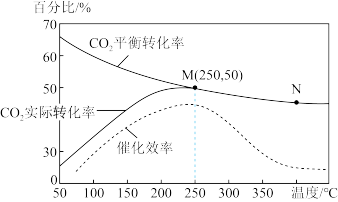
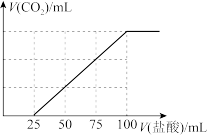
(3)把高炉出来的气体经过处理后通入NaOH溶液中完全吸收。再用0.01mol·L-1的盐酸溶液进行滴定,所得气体与滴入的盐酸体积的关系如图,则该溶液中所有离子浓度由大到小的顺序为:___________ 。
(1)已知高炉炼铁过程中会发生如下反应:FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH1
Fe2O3(s)+
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) ΔH3
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH4
则ΔH4的表达式为
(2)铁等金属可用作CO与氢气反应的催化剂。已知某种催化剂可用来催化反应CO(g)+3H2(g)
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| φ(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.200 | 0.200 |
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为
③某种含铁催化剂可以催化合成乙烯:6H2(g)+2CO2(g)

(3)把高炉出来的气体经过处理后通入NaOH溶液中完全吸收。再用0.01mol·L-1的盐酸溶液进行滴定,所得气体与滴入的盐酸体积的关系如图,则该溶液中所有离子浓度由大到小的顺序为:

铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
Fe2O3(s)+ CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ CO2(g) ∆H1
CO2(g) ∆H1
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) ∆H2
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ∆H3
则∆H3的表达式为___________ (用含∆H1、∆H2的代数式表示)。
(2)铁等金属可用作CO与氢气反应的催化剂。已知某种催化剂可用来催化反应CO(g)+3H2(g) CH4(g)+H2O(g) ∆H<0。在T℃、106Pa时将1molCO和3molH2加入容积可变的密闭容器中,实验测得CO的体积分数φ(CO)如下表所示:
CH4(g)+H2O(g) ∆H<0。在T℃、106Pa时将1molCO和3molH2加入容积可变的密闭容器中,实验测得CO的体积分数φ(CO)如下表所示:
①下列能判断反应CO(g)+3H2(g) CH4(g)+H2O(g)达到平衡的是
CH4(g)+H2O(g)达到平衡的是___________ (填序号)。
a.容器内压强不再发生变化
b.v正(CO)=3v逆(H2)
c.混合气体的密度不再发生变化
d.混合气体的平均相对分子质量不再发生变化
②达到平衡时H2的转化率为___________ (保留一位小数);在T℃、P0时该反应的压强平衡常数Kp=___________ (用简单分数表示,分压=总压×物质的量分数);第50min后,保持温度不变,向该密闭容器中再充入1molCO和3molH2,则H2的转化率___________ (填“增大”“减小”或“不变”)。
(3)某种含铁催化剂可以催化合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率、t时刻的实际转化率和催化剂催化效率的影响如图甲所示,结合图象分析温度低于250°C时CO2实际转化率变大的原因:
CH2=CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率、t时刻的实际转化率和催化剂催化效率的影响如图甲所示,结合图象分析温度低于250°C时CO2实际转化率变大的原因:___________ 。
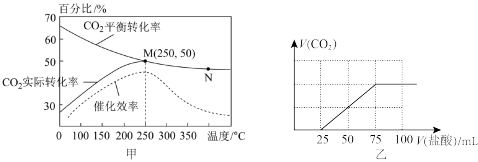
(4)把高炉出来的CO2气体经过处理后通入NaOH溶液中完全吸收。再用0.01mol·L-1的盐酸溶液进行滴定,所得气体与滴入的盐酸体积的关系如图乙,则该溶液中所有离子浓度由大到小的顺序为___________ 。
(1)已知高炉炼铁过程中会发生如下反应:
Fe2O3(s)+
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) ∆H2
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ∆H3
则∆H3的表达式为
(2)铁等金属可用作CO与氢气反应的催化剂。已知某种催化剂可用来催化反应CO(g)+3H2(g)
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| φ(CO) | 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①下列能判断反应CO(g)+3H2(g)
a.容器内压强不再发生变化
b.v正(CO)=3v逆(H2)
c.混合气体的密度不再发生变化
d.混合气体的平均相对分子质量不再发生变化
②达到平衡时H2的转化率为
(3)某种含铁催化剂可以催化合成乙烯:6H2(g)+2CO2(g)

(4)把高炉出来的CO2气体经过处理后通入NaOH溶液中完全吸收。再用0.01mol·L-1的盐酸溶液进行滴定,所得气体与滴入的盐酸体积的关系如图乙,则该溶液中所有离子浓度由大到小的顺序为
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。请回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g) Fe(s)+CO2(g) K1 ΔH1=a kJ·mol−1
Fe(s)+CO2(g) K1 ΔH1=a kJ·mol−1
3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) K2 ΔH2=b kJ·mol−1
2Fe3O4(s)+CO2(g) K2 ΔH2=b kJ·mol−1
Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) K3 ΔH3=c kJ·mol−1
3FeO(s)+CO2(g) K3 ΔH3=c kJ·mol−1
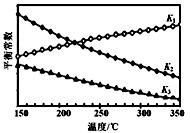
①Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=
2Fe(s)+3CO2(g) ΔH=_____ kJ·mol−1(用含a、b、c的代数式表示)。
②上述反应对应的平衡常数K1、K2、K3随温度变化的曲线如图所示。则a_________ b,(填“>”、“<”或“=”),理由是_________________ 。
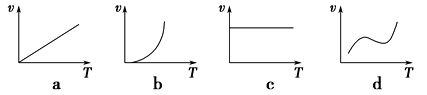
(2)铁的氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是________ 。
(3)铁等金属可用作CO与H2反应的催化剂:CO(g)+3H2(g) CH4(g)+H2O(g)
CH4(g)+H2O(g)
ΔH<0。在T℃,将l mol CO和3 mol H2加入2 L的密闭容器中。实验测得n(CO)随时间的变化如下表:
①下列能判断该反应达到平衡的标志是______ (填序号)。
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②在0~20 min内v (H2)=______ ;在T℃时该反应的平衡常数K=_________ 。
③下图表示该反应中CO的转化率与温度、压强的关系。图中压强P1、P2、P3由高到低的顺序是_________ 。

(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)
 Fe(s)+CO2(g) K1 ΔH1=a kJ·mol−1
Fe(s)+CO2(g) K1 ΔH1=a kJ·mol−13Fe2O3(s)+CO(g)
 2Fe3O4(s)+CO2(g) K2 ΔH2=b kJ·mol−1
2Fe3O4(s)+CO2(g) K2 ΔH2=b kJ·mol−1Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g) K3 ΔH3=c kJ·mol−1
3FeO(s)+CO2(g) K3 ΔH3=c kJ·mol−1
①Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g) ΔH=
2Fe(s)+3CO2(g) ΔH=②上述反应对应的平衡常数K1、K2、K3随温度变化的曲线如图所示。则a
(2)铁的氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是

(3)铁等金属可用作CO与H2反应的催化剂:CO(g)+3H2(g)
 CH4(g)+H2O(g)
CH4(g)+H2O(g) ΔH<0。在T℃,将l mol CO和3 mol H2加入2 L的密闭容器中。实验测得n(CO)随时间的变化如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
n(CO)/mol | 1.0 | 0.70 | 0.45 | 0.25 | 0.10 | 0.10 |
①下列能判断该反应达到平衡的标志是
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②在0~20 min内v (H2)=
③下图表示该反应中CO的转化率与温度、压强的关系。图中压强P1、P2、P3由高到低的顺序是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


