填空题 适中0.65 引用1 组卷119
汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除CO、NO等污染物。回答下列问题:
(1)消除CO、NO污染物的反应机理如下[Pt(s)表示催化剂,带“*”表示吸附状态]:
I.NO+Pt(s)=NO*;II.CO+Pt(s)=CO*;III.NO*=N*+O*;IV.CO*+O*=CO2+Pt(s);V.N*+N*=N2+Pt(s)
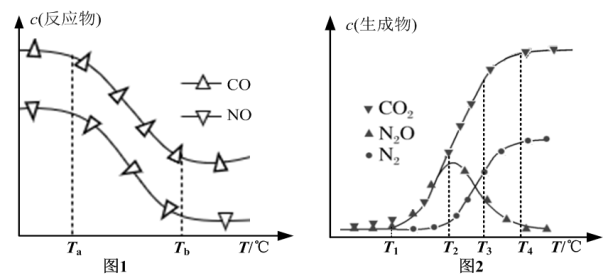
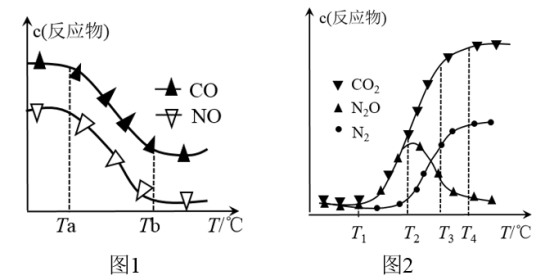
经测定汽车尾气中反应物浓度及生成物浓度随温度T变化关系如图一和图二所示。
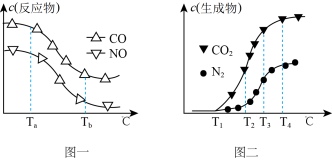
①图一中温度从Ta℃升至Tb℃的过程中,反应物浓度急剧减小的主要原因是_______ 。
②由图二知,T2℃时反应V的活化能_______ 反应IV的活化能(填“<”、“>”或“=”)。
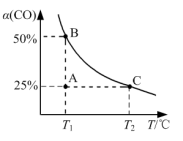
(2)为模拟汽车的“催化转化器”,将2molNO(g)和2mol CO(g)充入1L密闭容器中,加入催化剂后发生反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),测得CO的平衡转化率α随温度T变化曲线如图三所示。
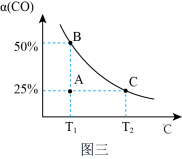
①图象中A点正反应速率_______ 逆反应速率(填“>”、“=”或“<”);
②T1℃,下列说法能表明该反应已达到平衡状态的是_______ (填序号)。
a.混合气体的密度不变b.体系的压强不变
c.混合气体中N2的体积分数不变d.2υ正(CO)=υ逆(N2)
(1)消除CO、NO污染物的反应机理如下[Pt(s)表示催化剂,带“*”表示吸附状态]:
I.NO+Pt(s)=NO*;II.CO+Pt(s)=CO*;III.NO*=N*+O*;IV.CO*+O*=CO2+Pt(s);V.N*+N*=N2+Pt(s)
经测定汽车尾气中反应物浓度及生成物浓度随温度T变化关系如图一和图二所示。

①图一中温度从Ta℃升至Tb℃的过程中,反应物浓度急剧减小的主要原因是
②由图二知,T2℃时反应V的活化能
(2)为模拟汽车的“催化转化器”,将2molNO(g)和2mol CO(g)充入1L密闭容器中,加入催化剂后发生反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),测得CO的平衡转化率α随温度T变化曲线如图三所示。

①图象中A点正反应速率
②T1℃,下列说法能表明该反应已达到平衡状态的是
a.混合气体的密度不变b.体系的压强不变
c.混合气体中N2的体积分数不变d.2υ正(CO)=υ逆(N2)
22-23高二上·山东临沂·阶段练习
类题推荐
减少机动车尾气中NO、和CO的排放是科学家一直关注研究的课题。
(1)用CO处理大气污染物N2O所发生的的反应为:N2O(g)+CO(g)=CO2(g)+N2(g) ΔH,几种物质的相对能量如下:
①ΔH=_______ kJ·mol-1。
②T℃时,将等物质的量的N2O和CO充入密闭容器中发生反应,下列事实能判断反应达到平衡状态的是_______ 。
A.气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.体系中N2O和CO的转化率相等
D. 比值不再变化
比值不再变化
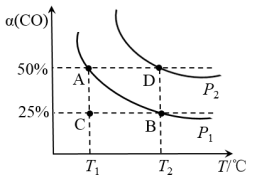
(2)模拟汽车的“催化转化器”,将2molNO(g)和2molCO(g)充入1L的密闭容器中,在不同温度和压强下发生反应2NO(g)+2CO(g)-N2(g)+2CO2(g),测得CO的平衡转化率α随温度T变化曲线如图所示。图象中C点逆反应速率_______ B点正反应速率(填“>”“=”或“<”,下同);反应的平衡常数:A点_______ D点。实验测得:v正=k正∙c2(NO)∙c2(CO),v逆=k逆∙c(N2)∙c2(CO2),k正、k逆分别是正、逆反应速率常数。则T1℃时C点处对应的v正:v逆=_______ 。
(3)汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除CO、NO等污染物。反应机理如下[Pt(s)表示催化剂,右上角带“*”表示吸附状态]:
I.NO+Pt(s)=NO* II.CO+Pt(s)=CO* III.NO*=N*+O*
IV.CO*+O*=CO2+Pt(s) V.N*+N*=N2+Pt(s) VI.NO*+N*=N2O+Pt(s)
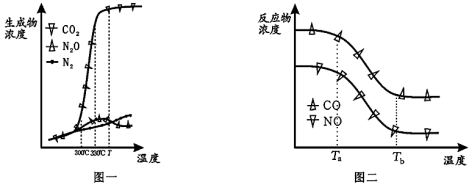
经测定汽车尾气中反应物浓度及生成物浓度随温度T变化关系如图1和图2所示。
①图1中温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是_______ 。
②图2中温度T2℃时反应V的活化能_______ 反应VI的活化能(填“<”、“>”或“=”);温度T3℃时发生的主要反应为_______ (选填“IV”或“V”或“VI”)。
(1)用CO处理大气污染物N2O所发生的的反应为:N2O(g)+CO(g)=CO2(g)+N2(g) ΔH,几种物质的相对能量如下:
| 物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
| 相对能量kJ∙mol-1 | 475.5 | 283 | 0 | 393.5 |
②T℃时,将等物质的量的N2O和CO充入密闭容器中发生反应,下列事实能判断反应达到平衡状态的是
A.气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.体系中N2O和CO的转化率相等
D.
(2)模拟汽车的“催化转化器”,将2molNO(g)和2molCO(g)充入1L的密闭容器中,在不同温度和压强下发生反应2NO(g)+2CO(g)-N2(g)+2CO2(g),测得CO的平衡转化率α随温度T变化曲线如图所示。图象中C点逆反应速率

(3)汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除CO、NO等污染物。反应机理如下[Pt(s)表示催化剂,右上角带“*”表示吸附状态]:
I.NO+Pt(s)=NO* II.CO+Pt(s)=CO* III.NO*=N*+O*
IV.CO*+O*=CO2+Pt(s) V.N*+N*=N2+Pt(s) VI.NO*+N*=N2O+Pt(s)
经测定汽车尾气中反应物浓度及生成物浓度随温度T变化关系如图1和图2所示。

①图1中温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是
②图2中温度T2℃时反应V的活化能
氮元素有多种化合物。生产生活中氨及铵盐有重要用途,而汽车尾气中含有的 NO、NO2因有害则应降低其排放。回答下列问题:
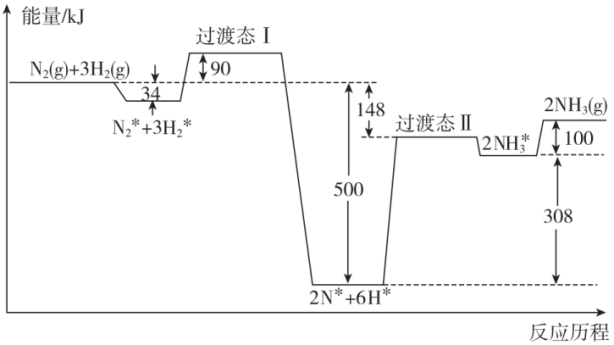
(1)在 20℃ 时,已知:
①N2(g)+O2(g)⇌2NO(g) 正、逆反应活化能分别为 akJ•mol-1、bkJ•mol-1
②4NH3(g)+5O2(g)⇌4NO(g)+6H2O(l) 正、逆反应活化能分别为 ckJ•mol-1、dkJ•mol-1
则 4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)的△H 为__________________ 。
(2)10.0L 的密闭容器中,按物质的量比 1:3 投入氮气和氢气,发生反应:N2(g)+3H2(g)⇌2NH3(g) △H <0,用传感器测得温度为 T1、T2时容器中 n(N2)随时间变化如下表:
①T1 时,该反应的平衡常数为_________ (用最简分数表示);
②x_______________ 0.06(填“>”、“<”或“=”),原因是____________________ 。
(3)汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除 CO、NO 等污染物。反应机理如下[Pt(s)表示催化剂,右上角带“*”表示吸附状态]:
I NO+Pt(s)=NO* II CO+Pt(s)=CO*
III NO*=N*+O* IV CO*+O*=CO2+Pt(s)
V N*+N*=N2+Pt(s) VI NO*+N*=N2O+Pt(s)
经测定汽车尾气中反应物及生成物浓度随温度变化的关系如图一和图二所示。
①图一中,温度为330℃时发生的主要反应为____ (填“IV”、“V”或“VI”);反应VI为____ 反应(填“放热”或“吸热”)。
②图二中,温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是___ 。
③已知气体在固体催化剂表面反应中,吸附和解吸过程同时影响总反应速率。温度一定时,反应2NO+2CO N2+2CO2的总反应速率随压强的变化如图所示。
N2+2CO2的总反应速率随压强的变化如图所示。
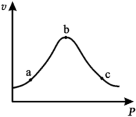
结合(3)中反应机理,解释 bc 段化学反应速率下降的原因____ 。
(1)在 20℃ 时,已知:
①N2(g)+O2(g)⇌2NO(g) 正、逆反应活化能分别为 akJ•mol-1、bkJ•mol-1
②4NH3(g)+5O2(g)⇌4NO(g)+6H2O(l) 正、逆反应活化能分别为 ckJ•mol-1、dkJ•mol-1
则 4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)的△H 为
(2)10.0L 的密闭容器中,按物质的量比 1:3 投入氮气和氢气,发生反应:N2(g)+3H2(g)⇌2NH3(g) △H <0,用传感器测得温度为 T1、T2时容器中 n(N2)随时间变化如下表:
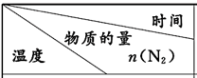 | 0 | 5 min | 10 min | 15 min | 20min |
T1 | 0.1mol | 0.08 mol | 0.062 mol | 0.05 mol | 0.05 mol |
T2 | 0.1 mol | 0.07 mol | - | x mol | 0.06 mol |
②x
(3)汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除 CO、NO 等污染物。反应机理如下[Pt(s)表示催化剂,右上角带“*”表示吸附状态]:
I NO+Pt(s)=NO* II CO+Pt(s)=CO*
III NO*=N*+O* IV CO*+O*=CO2+Pt(s)
V N*+N*=N2+Pt(s) VI NO*+N*=N2O+Pt(s)
经测定汽车尾气中反应物及生成物浓度随温度变化的关系如图一和图二所示。

①图一中,温度为330℃时发生的主要反应为
②图二中,温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是
③已知气体在固体催化剂表面反应中,吸附和解吸过程同时影响总反应速率。温度一定时,反应2NO+2CO

结合(3)中反应机理,解释 bc 段化学反应速率下降的原因
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网