解答题-原理综合题 适中0.65 引用5 组卷482
落实“双碳”目标,发展绿色能源,首先是对氢能源的开发利用。利用甲烷制氢是当前研究的热点。涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)反应Ⅰ的活化能为 ,反应Ⅰ逆反应的活化能为
,反应Ⅰ逆反应的活化能为_______  。研究发现,以单一负载型
。研究发现,以单一负载型 催化反应Ⅰ时,反应Ⅰ的逆反应在催化剂表面存在两种活性中心,分别以“*”和“#”表示,在活性位“*”上发生
催化反应Ⅰ时,反应Ⅰ的逆反应在催化剂表面存在两种活性中心,分别以“*”和“#”表示,在活性位“*”上发生 吸附,在活性位“#”上被吸附的
吸附,在活性位“#”上被吸附的 发生分解反应生成表面碳,表面碳再与
发生分解反应生成表面碳,表面碳再与 结合生成
结合生成 ,其催化反应机理的反应式如下:
,其催化反应机理的反应式如下:
ⅰ. 快速平衡
快速平衡
ⅱ. 慢反应
慢反应
ⅲ. 快反应
快反应
ⅳ._______ 快反应
反应ⅳ的反应式为_______ ;反应Ⅰ逆反应的决速步骤是_______ (填反应序号)。
(2) 时,在某密闭容器中通入一定量的
时,在某密闭容器中通入一定量的 和
和 ,加入金属镍做催化剂,在一定温度下发生上述反应。
,加入金属镍做催化剂,在一定温度下发生上述反应。
①为提高 的平衡转化率,除改变温度外,还可以采取的措施是
的平衡转化率,除改变温度外,还可以采取的措施是_______ 。
②恒温恒容条件下,起始时 和
和 的浓度分别为
的浓度分别为 和
和 ,达平衡时
,达平衡时 和
和 的浓度分别为
的浓度分别为 和
和 。达平衡时,
。达平衡时, 的浓度是
的浓度是_______  ,反应Ⅰ的平衡常数K是
,反应Ⅰ的平衡常数K是_______ 。(用含a、b、c、d的代数式表示)
③在该温度下,反应Ⅲ的标准平衡常数
_______ 。[已知:分压=总压×该组分物质的量分数,对于反应 ,
, ,其中
,其中 ,
, 为各组分的平衡分压]
为各组分的平衡分压]
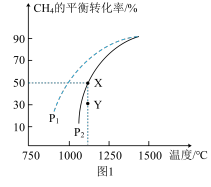
(3)在某一给定进料比的情况下,温度、压强对平衡体系中 物质的量分数的影响如下图:
物质的量分数的影响如下图:
压强由大到小的顺序为_______ ,体系温度未达到 时,
时, 物质的量分数几乎为0的原因是
物质的量分数几乎为0的原因是_______ 。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)反应Ⅰ的活化能为
ⅰ.
ⅱ.
ⅲ.
ⅳ._______ 快反应
反应ⅳ的反应式为
(2)
①为提高
②恒温恒容条件下,起始时
③在该温度下,反应Ⅲ的标准平衡常数
(3)在某一给定进料比的情况下,温度、压强对平衡体系中

压强由大到小的顺序为
22-23高三上·山东潍坊·期中
知识点:根据△H=反应物的键能之和-生成物的键能之和进行计算影响化学反应速率的外因化学平衡的有关计算产物的物质的量与温度、压强的图像关系分析 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网