解答题-结构与性质 适中0.65 引用1 组卷29
Ⅰ. X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为 nsnnpn+2。请填写下列空白。
(1)写出X元素M层的电子排布式_______ 。
(2)XY2是一种高效安全的消毒剂,熔点 -59.5 ℃,沸点10 ℃,构成该晶体的微粒之间的作用力是_______ 。
(3)ZX2 常用于有机合成。ZX2 分子的空间构型是_______ 。写出 ZX2 的等电子体(分子离子各一个)_______ 、_______ 。
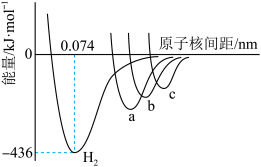
(4)图中四条曲线分别表示H2、Cl2、Br2、I2分子的形成过程中能量随原子核间距的变化关系,其中表示Cl2 的是曲线_______ (填“a”、“b”或“c”),理由是_______ 。
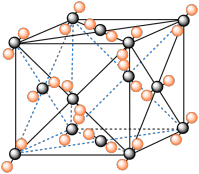
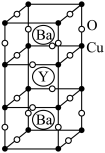
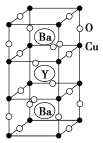
Ⅱ. 钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价。
(5)根据下图所示晶胞结构,推算晶体中Y、Cu、Ba和O原子个数比,确定其化学式为_______ ;
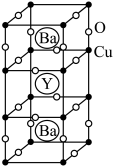
(6)根据(5)所推出的化合物的组成,(该化合物中各元素的化合价为Y +3、Ba +2),计算该物质中+2价和+3价的Cu离子个数比为_______ 。
(1)写出X元素M层的电子排布式
(2)XY2是一种高效安全的消毒剂,熔点 -59.5 ℃,沸点10 ℃,构成该晶体的微粒之间的作用力是
(3)ZX2 常用于有机合成。ZX2 分子的空间构型是
(4)图中四条曲线分别表示H2、Cl2、Br2、I2分子的形成过程中能量随原子核间距的变化关系,其中表示Cl2 的是曲线

Ⅱ. 钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价。
(5)根据下图所示晶胞结构,推算晶体中Y、Cu、Ba和O原子个数比,确定其化学式为

(6)根据(5)所推出的化合物的组成,(该化合物中各元素的化合价为Y +3、Ba +2),计算该物质中+2价和+3价的Cu离子个数比为
21-22高二下·河南三门峡·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网