解答题-工业流程题 适中0.65 引用1 组卷119
钠及其化合物的生产、应用,是化工生产与研究的重要组成部分。
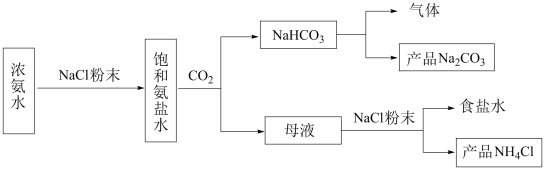
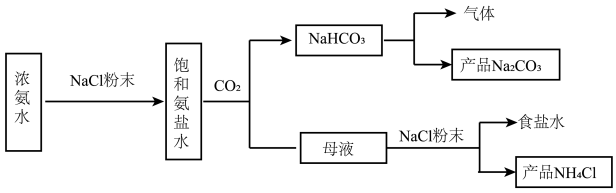
I.化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如图:
,实验流程如图:

回答下列问题:
(1)生成 的总反应的化学方程式为
的总反应的化学方程式为_______ 。
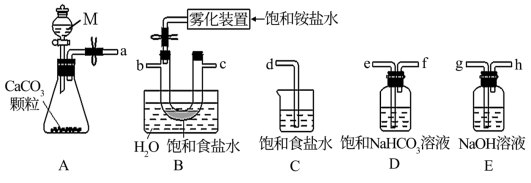
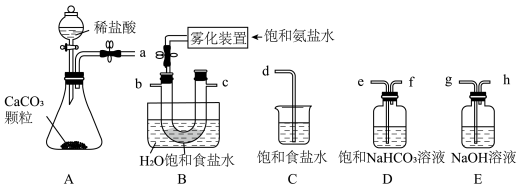
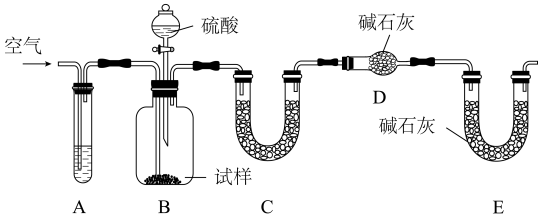
(2)从下图A~E中选择合适的仪器制备 ,正确的连接顺序是
,正确的连接顺序是_______ (按气流方向,用小写字母表示);A中仪器M的名称为_______ ,B中使用雾化装置的优点是_______ 。
A.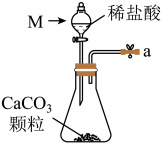 B.
B.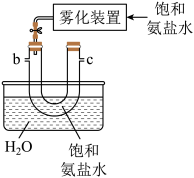
C. D.
D. 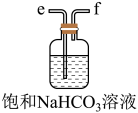 E.
E.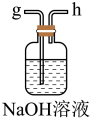
(3)反应完成后,将B中U形管内的混合物处理得到固体 和滤液:
和滤液:
①灼烧 ,发生反应为:
,发生反应为:
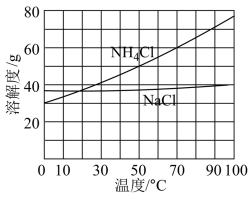
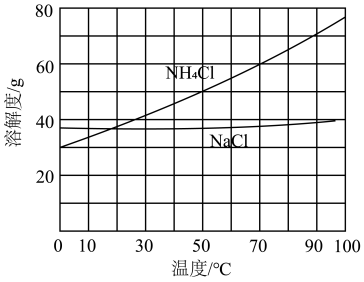
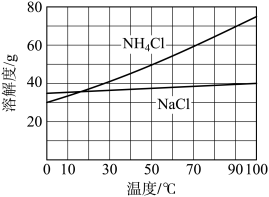
②向滤液中加入NaCl粉末,存在 过程。为使
过程。为使 沉淀充分析出并分离,根据NaCl和
沉淀充分析出并分离,根据NaCl和 溶解度曲线,需采用的操作为蒸发浓缩、
溶解度曲线,需采用的操作为蒸发浓缩、_______ 、过滤、洗涤、干燥。
(4)工业纯碱中可能混有少量NaCl,同学们对工业纯碱样品展开探究。
探究:测定纯碱样品中 的质量分数
的质量分数
【方案1】称取m g样品溶解,加入过量 溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中
溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中 的质量分数为
的质量分数为_______ 。
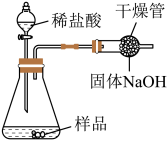
【方案2】如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算 的质量分数。若结果大于100%,可能的原因是
的质量分数。若结果大于100%,可能的原因是_______ 。
II.工业上以侯氏制碱法为基础生产焦亚硫酸钠( ,能溶于水)的工艺流程如下:
,能溶于水)的工艺流程如下:
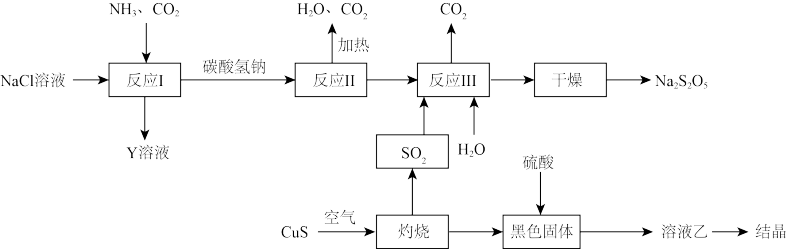
(5)关于上述流程,下列说法不正确的是_______(填字母)。
(6)反应III包含多步反应:
第一步:……
第二步:
为了减少产品 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的化学计量数之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的化学计量数之比为_______ 。
I.化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备

回答下列问题:
(1)生成
(2)从下图A~E中选择合适的仪器制备
A.
 B.
B.
C.
 D.
D.  E.
E.
(3)反应完成后,将B中U形管内的混合物处理得到固体
①灼烧
②向滤液中加入NaCl粉末,存在

(4)工业纯碱中可能混有少量NaCl,同学们对工业纯碱样品展开探究。
探究:测定纯碱样品中
【方案1】称取m g样品溶解,加入过量
【方案2】如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算

II.工业上以侯氏制碱法为基础生产焦亚硫酸钠(

(5)关于上述流程,下列说法不正确的是_______(填字母)。
| A.氨气溶于水使溶液呈碱性的原因是: |
| B.反应I是置换反应 |
| C.该流程中, |
| D.溶液乙的结晶产物是硫酸铜晶体 |
第一步:……
第二步:
为了减少产品
22-23高一上·山西晋城·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网