填空题 适中0.65 引用1 组卷69
实验是化学学习的基础,请完成以下实验填空:
(1)某实验小组用0.50mol/LNaOH溶液和0.55mol/L硫酸溶液进行中和热的测定,取50mLNaOH溶液和25mL硫酸溶液进行实验,实验数据如表。
近似认为0.50mol/LNaOH溶液和0.55mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃),则该中和反应生成1molH2O反应热△H=____ (取小数点后两位)。
(2)已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3kJ•mol-1;
P(s,白磷)=P(s,红磷) ΔH=-17.6kJ•mol-1;
由此推知,其中最稳定的磷单质是____ 。
(3)在298K、100kPa时,已知:C(s,石墨)的燃烧热为393.5kJ•mol-1;
H2(g)的燃烧热为285.8kJ•mol-1;C2H2(g)的燃烧热为1299.5kJ•mol-1。
则2C(s,石墨)+H2(g) C2H2(g) △H=
C2H2(g) △H=____ kJ•mol-1。
(4)在2L的恒温容器中加入240g石墨和足量氢气发生反应:2C(s,石墨)+H2(g) C2H2(g)。能判断该反应达到化学平衡状态的依据是
C2H2(g)。能判断该反应达到化学平衡状态的依据是____ 。
A.v(H2)=v(C2H2)
B.容器中的气体压强不再改变
C.容器中的气体密度不再改变
D.石墨的质量不再改变
E.断开1molH-H键时,同时生成2molC-H键
(5)在绝热恒容密闭容器中加入1molX和3molY发生反应:X(g)+3Y(g) 4Z(g) △H<0。
4Z(g) △H<0。
①相同时间内生成Z的量比恒温恒容时多,原因是___ 。
②当气体压强不再变化时,该反应____ (填“是”或“否”)达到平衡状态。
(1)某实验小组用0.50mol/LNaOH溶液和0.55mol/L硫酸溶液进行中和热的测定,取50mLNaOH溶液和25mL硫酸溶液进行实验,实验数据如表。
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.6 | a |
| 2 | 27.0 | 27.4 | 27.2 | 31.8 | |
| 3 | 25.9 | 25.9 | 25.9 | 30.3 | |
| 4 | 26.4 | 26.2 | 26.3 | 31.9 | |
近似认为0.50mol/LNaOH溶液和0.55mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃),则该中和反应生成1molH2O反应热△H=
(2)已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3kJ•mol-1;
P(s,白磷)=P(s,红磷) ΔH=-17.6kJ•mol-1;
由此推知,其中最稳定的磷单质是
(3)在298K、100kPa时,已知:C(s,石墨)的燃烧热为393.5kJ•mol-1;
H2(g)的燃烧热为285.8kJ•mol-1;C2H2(g)的燃烧热为1299.5kJ•mol-1。
则2C(s,石墨)+H2(g)
(4)在2L的恒温容器中加入240g石墨和足量氢气发生反应:2C(s,石墨)+H2(g)
A.v(H2)=v(C2H2)
B.容器中的气体压强不再改变
C.容器中的气体密度不再改变
D.石墨的质量不再改变
E.断开1molH-H键时,同时生成2molC-H键
(5)在绝热恒容密闭容器中加入1molX和3molY发生反应:X(g)+3Y(g)
①相同时间内生成Z的量比恒温恒容时多,原因是
②当气体压强不再变化时,该反应
22-23高二上·黑龙江哈尔滨·阶段练习
类题推荐
(1)CH3OH(l)+O2(g)=CO(g)+2H2O(g) ΔH=-393 kJ·mol-1该反应相关化学键键能数据如表:
则X=____ 。
(2)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。
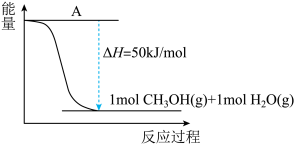
①补全上图:图中A处应填入____ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应ΔH____ (填“变大”“变小”“不变”)。
③已知:CO(g)+ O2(g)=CO2(g) ΔH1=-283 kJ·mol-1
O2(g)=CO2(g) ΔH1=-283 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH2=-242 kJ·mol-1
O2(g)=H2O(g) ΔH2=-242 kJ·mol-1
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) ΔH3=-676 kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH3=-676 kJ·mol-1
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g)+2H2(g)=CH3OH(g),该反应的ΔH=__ kJ·mol-1。
(3)中和热的测定是高中重要的定量实验。取0.55 mol/L的NaOH溶液50 mL与0.25 mol/L的硫酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
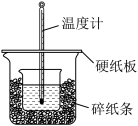
①从上图实验装置看,其中尚缺少的一种玻璃用品是_________ ,除此之外,装置中的一个明显错误是 ______________________ 。
②若改用60 mL 0.25 mol·L-1 H2SO4和50 mL 0.55 mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量_________ (填“相等”.“不相等”),若实验操作均正确,则所求中和热_________ (填“相等”“不相等”)。
(4)实验数据如表:
①请填写下表中的空白:
②近似认为50 mL0.55 mol/L NaOH溶液和50 mL 0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。(已知:Q=cm△t)则中和热ΔH=______ ( 取小数点后一位)。
| 化学键 | O=OOO | C-O | 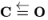 | H-O | C-H |
| E/( kJ·mol-1) | X | 343 | 1076 | 465 | 413 |
(2)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。

①补全上图:图中A处应填入
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应ΔH
③已知:CO(g)+
H2(g)+
CH3OH(g)+
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g)+2H2(g)=CH3OH(g),该反应的ΔH=
(3)中和热的测定是高中重要的定量实验。取0.55 mol/L的NaOH溶液50 mL与0.25 mol/L的硫酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题:

①从上图实验装置看,其中尚缺少的一种玻璃用品是
②若改用60 mL 0.25 mol·L-1 H2SO4和50 mL 0.55 mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量
(4)实验数据如表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


