解答题-原理综合题 适中0.65 引用1 组卷83
Ⅰ.已知:①
 ;
;
②

(1)Al和FeO发生铝热反应的热化学方程式是_______ 。
(2)据报道,科学家在一定条件下利用 与甲烷反应可制取“纳米级”的金属铁。其反应为:
与甲烷反应可制取“纳米级”的金属铁。其反应为:

①若反应在5L的密闭容器中进行,1min后达到平衡,测得 在反应中质量减少3.2g。则该段时间内CO的平均反应速率为
在反应中质量减少3.2g。则该段时间内CO的平均反应速率为_______ 。
②若该反应在恒温恒容容器中进行,能表明该反应达到平衡状态的是_______ 。
A. 的转化率等于CO的产率 B.混合气体的密度不变
的转化率等于CO的产率 B.混合气体的密度不变
C. 与
与 的比值为1∶2 D.固体的总质量不变
的比值为1∶2 D.固体的总质量不变
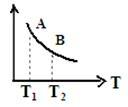
③该反应达到平衡时某物理量随温度变化如图所示,当温度由 升高到
升高到 时,平衡常数
时,平衡常数
_______  (填“>”、“<”或“=”);以下选项中纵坐标可以表示的物理量有
(填“>”、“<”或“=”);以下选项中纵坐标可以表示的物理量有_______ 。
A. 的逆反应速率 B.
的逆反应速率 B. 的的体积分数
的的体积分数
C.混合气体的平均相对分子质量 D.CO的体积分数
Ⅱ.已知
 ,在一个有催化剂的容积不变的密闭容器中加入
,在一个有催化剂的容积不变的密闭容器中加入 和
和 。在500℃时充分反应,达平衡后
。在500℃时充分反应,达平衡后 的浓度为
的浓度为 ,放出热量为
,放出热量为 。
。
(3)下列措施可以同时提高反应速率和 的转化率是_______。
的转化率是_______。
(4)达到平衡时, 的转化率为
的转化率为_______ (用 、
、 表示)。
表示)。
(5)将上述容器改为恒压容器,起始时加入 和
和 ,500℃时充分反应达平衡后,放出热量
,500℃时充分反应达平衡后,放出热量 ,则
,则
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
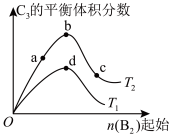
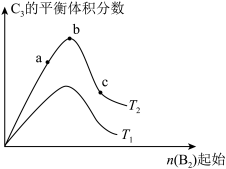
(6)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是_______。
②
(1)Al和FeO发生铝热反应的热化学方程式是
(2)据报道,科学家在一定条件下利用
①若反应在5L的密闭容器中进行,1min后达到平衡,测得
②若该反应在恒温恒容容器中进行,能表明该反应达到平衡状态的是
A.
C.
③该反应达到平衡时某物理量随温度变化如图所示,当温度由

A.
C.混合气体的平均相对分子质量 D.CO的体积分数
Ⅱ.已知
(3)下列措施可以同时提高反应速率和
| A.选择适当的催化剂 | B.增大压强 |
| C.及时分离生成的 | D.升高温度 |
(5)将上述容器改为恒压容器,起始时加入
(6)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是_______。

| A.反应速率c>b>a | B.达到平衡时 |
| C. | D.b点 |
22-23高二上·重庆江津·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网