解答题-原理综合题 适中0.65 引用1 组卷108
汽车尾气中含有CO和NO等,可以用不同的方法净化处理,防止空气污染。回答下列问题:
(1)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其反应为2CO(g)+2NO(g) 2CO2(g)+N2(g) △H。
2CO2(g)+N2(g) △H。
①该反应在常温下能自发进行,则该反应的△H_______ 0(填“>”或“<”)。
②将CO和NO以一定流速通过两种不同的催化剂发生上述反应、相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如下图所示:
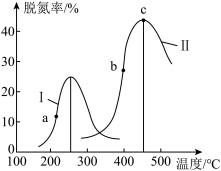
a点的v逆_______ b点的v正(填“>”“<”或“=”')。c点_______ (填“一定”或“不一定”)是平衡状态。
③对于反应2CO(g)+2NO(g) 2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
2CO2(g)+N2(g),在实验中测得:v正= k正·c2(CO)·c2(NO)、v逆= k逆·c2(CO2)·c (N2),k正、k逆分别是正、逆反应速率常数,且只是温度的函数。
T℃,将2 mol CO(g)和2 mol NO(g)通入体积为1 L的恒容密闭容器发生上述反应,反应平衡时,CO(g)的转化率为50%,则当CO(R)的转化率为25%时,v正:v逆=_______ 。
(2)二氧化铈(CeO2)在汽车尾气中CO的催化消除中有将广泛的应用,同时二氧化铈(CeO2)负载贵金属(Rh)和贵金属氧化物(Rh2O3)后催化活性的变化如下图所示。下列说法正确的是_______ (填标号)。
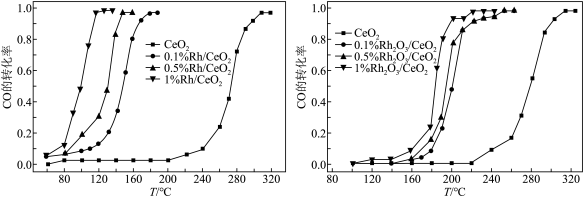
A.200℃时,复合催化剂比单一催化剂效率更高
B.在相同温度下,负载Rh2O3后催化剂的活性大于负载Rh的催化剂的活性
C.催化剂的活性随着负载Rh的增高而增大,促进了CO催化消除反应的平衡向正向移动
(3)用尿素水解生成的NH3催化还原NO,是柴油机车车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g) 2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是
2N2(g)+6H2O(g)。实际应用中,加入尿素的量并不是越多越好,原因是__________ ,为了避免尿素过多造成的影响,可接一个氧化催化器,则氧化催化器中反应的化学方程式为_______ 。
(1)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其反应为2CO(g)+2NO(g)
①该反应在常温下能自发进行,则该反应的△H
②将CO和NO以一定流速通过两种不同的催化剂发生上述反应、相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如下图所示:

a点的v逆
③对于反应2CO(g)+2NO(g)
T℃,将2 mol CO(g)和2 mol NO(g)通入体积为1 L的恒容密闭容器发生上述反应,反应平衡时,CO(g)的转化率为50%,则当CO(R)的转化率为25%时,v正:v逆=
(2)二氧化铈(CeO2)在汽车尾气中CO的催化消除中有将广泛的应用,同时二氧化铈(CeO2)负载贵金属(Rh)和贵金属氧化物(Rh2O3)后催化活性的变化如下图所示。下列说法正确的是

A.200℃时,复合催化剂比单一催化剂效率更高
B.在相同温度下,负载Rh2O3后催化剂的活性大于负载Rh的催化剂的活性
C.催化剂的活性随着负载Rh的增高而增大,促进了CO催化消除反应的平衡向正向移动
(3)用尿素水解生成的NH3催化还原NO,是柴油机车车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g)
22-23高三上·湖北随州·阶段练习
类题推荐
机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1 =− 393.5kJ·mol−1
2C(s)+O2(g)=2CO(g) △H2 =− 221.0 kJ·mol−1
N2(g)+O2(g)=2NO(g) △H3 =+180.5 kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是___________ 。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如表:
①前4 s内的平均反应速率υ(CO) =___________ mol·L−1·s−1。
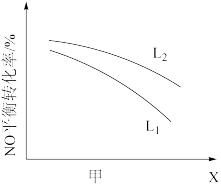
② L、X可分别代表压强或温度。如图,表示L一定时,NO(g)的平衡转化率随X的变化关系。
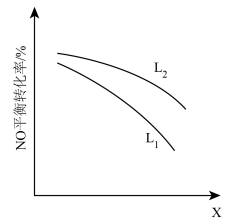
X代表的物理量是___________ 。判断:L1___________ L2的大小关系(填“>”、“<”或“=”),原因是:___________ 。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达平衡后,仅升高温度,k正增大的倍数___________ (填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________ 。(保留一位小数)
II.有人利用反应C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH = −34.0 kJ·mol−1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图所示。
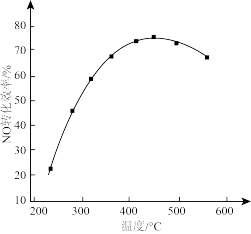
由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率___________ (填“是”或者“不是”)对应温度下的平衡转化率;高于450℃时,NO的转化率降低的可能原因是___________ (填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1 =− 393.5kJ·mol−1
2C(s)+O2(g)=2CO(g) △H2 =− 221.0 kJ·mol−1
N2(g)+O2(g)=2NO(g) △H3 =+180.5 kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10−4mol·L−1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10−3mol·L−1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
② L、X可分别代表压强或温度。如图,表示L一定时,NO(g)的平衡转化率随X的变化关系。

X代表的物理量是
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达平衡后,仅升高温度,k正增大的倍数
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =
II.有人利用反应C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH = −34.0 kJ·mol−1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图所示。

由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
环境保护是当今社会的热门问题,而氮的氧化物是大气污染的主要物质,研究氮的氧化物的反应对于减少污染有重要意义。请根据所学化学知识回答下列问题:
(1)汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成N2,可有效降低汽车尾气污染。已知:
N2(g)+O2(g) 2NO(g) △H=+180.5 kJ·mol-1
2NO(g) △H=+180.5 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221.0 kJ·mol-1
2CO(g) △H=-221.0 kJ·mol-1
则尾气转化反应2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=___________ kJ·mol-1
(2)向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
①下列事实能说明反应达平衡状态的是___________ (填序号)
A.容器内气体的压强不变
B.容器内气体的密度不变
C.容器内气体的平均相对分子质量不变
②计算此温度下,该反应的平衡常数K=___________ L·mol-1。
③保持温度和容积不变,向平衡体系中再充入NO和N2,使二者浓度均增加至原来的两倍,此时平衡移动___________ (填“向正反应方向”“向逆反应方向”或“不”)。
④实验测得,v正=k正・c2(NO)・c2(CO),v逆=k逆•c2(N2)·c (CO2)、(k正、k逆为速率常数,只与温度有关)。达到平衡后,仅升高温度,k正增大的倍数___________ (填“>”“<”或“=")k逆增大的倍数。
⑤L、X可分别代表压强或温度。图甲表示L一定时,NO(g)的平衡转化率随X的变化关系,则X代表___________ 。判断L1、L2的大小关系,并简述理由:___________
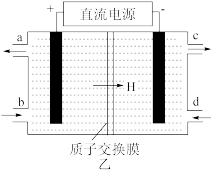
(3)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成NO 和NO
和NO 。可采用电解法将上述吸收液中的NO
。可采用电解法将上述吸收液中的NO 转化为无毒物质,同时再生Ce4+,其原理如图乙所示。写出阴极的电极反应式
转化为无毒物质,同时再生Ce4+,其原理如图乙所示。写出阴极的电极反应式___________ 。
(1)汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成N2,可有效降低汽车尾气污染。已知:
N2(g)+O2(g)
C(s)+O2(g)
2C(s)+O2(g)
则尾气转化反应2NO(g)+2CO(g)
(2)向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(NO)/(10-3 mol·L-1) | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
| c(CO)/(10-3 mol·L-1) | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
①下列事实能说明反应达平衡状态的是
A.容器内气体的压强不变
B.容器内气体的密度不变
C.容器内气体的平均相对分子质量不变
②计算此温度下,该反应的平衡常数K=
③保持温度和容积不变,向平衡体系中再充入NO和N2,使二者浓度均增加至原来的两倍,此时平衡移动
④实验测得,v正=k正・c2(NO)・c2(CO),v逆=k逆•c2(N2)·c (CO2)、(k正、k逆为速率常数,只与温度有关)。达到平衡后,仅升高温度,k正增大的倍数
⑤L、X可分别代表压强或温度。图甲表示L一定时,NO(g)的平衡转化率随X的变化关系,则X代表


(3)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成NO
研究处理NOx对环境保护有着重要的意义。回答下列问题:
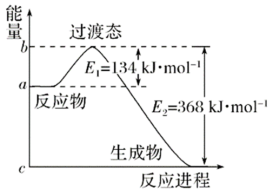
(1)如图是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1__ (填“增大”“减小”或“不变”,下同),△H__ 。请写出NO2和CO反应的热化学方程式:___ 。
(2)一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ•mol-1
下列选项正确的是__ (填标号)。
(3)利用反应C(s)+2NO(g)=N2(g)+CO2(g) △H=-34.0kJ•mol-1,一定条件下消除NO的污染。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率α(NO)随温度的变化如图所示:
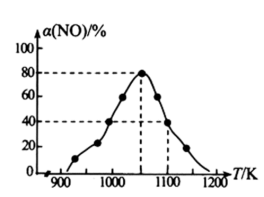
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__ ;在1100K时,CO2的体积分数为__ 。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=__ (已知:气体分压=气体总压×体积分数)。
(4)在汽车尾气的净化装置中CO和NO发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H2=-746.8kJ•mol-1。实验测得,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H2=-746.8kJ•mol-1。实验测得,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数__ (填">”、“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为40%,则 =
=__ (保留2位有效数字)。
(1)如图是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1

(2)一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ•mol-1
下列选项正确的是
| A.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ•mol-1 |
| B.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H3>△H1 |
| C.若用0.2molCH4还原NO2至N2,则反应中放出的热量一定为173.4kJ |
| D.若用标准状况下2.24LCH4还原NO2至N2,整个过程中转移的电子为1.6mol |

①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=
(4)在汽车尾气的净化装置中CO和NO发生反应:2NO(g)+2CO(g)
①达到平衡后,仅升高温度,k正增大的倍数
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为40%,则
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


