解答题-实验探究题 0.4 引用2 组卷654
乙酸乙酯是具有优异的溶解能力,是极好的工业溶剂。现用如图所示装置制备乙酸乙酯。
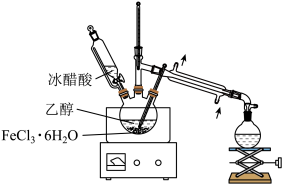
实验步骤如下:向三颈烧瓶中加入23mL 95%的乙醇(含 ),再加入
),再加入 和几粒沸石,滴液漏斗中加入14.5mL冰醋酸(含
和几粒沸石,滴液漏斗中加入14.5mL冰醋酸(含 );如图连接好装置,开始加热,缓缓滴入冰醋酸。
);如图连接好装置,开始加热,缓缓滴入冰醋酸。
已知:Ⅰ.由羧酸和醇生成酯的反应机理如下
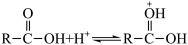 (成质子化)
(成质子化)
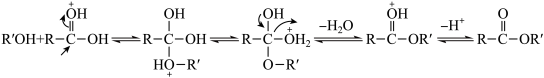 (脱质子化)
(脱质子化)
Ⅱ.乙酸乙酯的密度为0.9g/mL。
Ⅲ.乙醇可与 结合形成
结合形成 难溶物。
难溶物。
(1)上述实验中制备乙酸乙酯的化学方程式为_______ 。
(2)实验中适合的三颈烧瓶的容积为_______(填选项字母)。
(3)实验测得温度为80℃时产率最高,温度过高造成产率下降,可能的原因是:_______ 。
(4)与采用浓硫酸相比,选用 作为催化剂的优点为
作为催化剂的优点为_______ 在写一点)。根据羧酸和醇生成酯的反应机理推测,下列物质中可用作制备乙酸乙酯催化剂的是_______ (填选项字母)。
A. B.
B. C.
C. D.
D.
(5)对得到的乙酸乙酯粗产品提纯:
①向粗产品中加入碳酸钠粉末。
②向其中加入饱和氯化钙溶液,振荡、静置、分液,目的是_______ 。
③向所得有机层中加入无水硫酸钠,过滤。加入无水硫酸钠的作用是_______ 。
(6)最终得到乙酸乙酯19.6mL,则该实验中乙酸乙酯的产率为_______ (保留两位有效数字,乙酸乙酯的相对分子质量为88)。

实验步骤如下:向三颈烧瓶中加入23mL 95%的乙醇(含
已知:Ⅰ.由羧酸和醇生成酯的反应机理如下
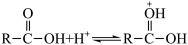 (成质子化)
(成质子化)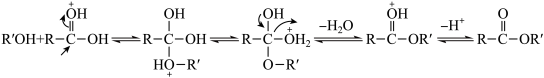 (脱质子化)
(脱质子化)Ⅱ.乙酸乙酯的密度为0.9g/mL。
Ⅲ.乙醇可与
(1)上述实验中制备乙酸乙酯的化学方程式为
(2)实验中适合的三颈烧瓶的容积为_______(填选项字母)。
| A. | B. | C. | D. |
(4)与采用浓硫酸相比,选用
A.
(5)对得到的乙酸乙酯粗产品提纯:
①向粗产品中加入碳酸钠粉末。
②向其中加入饱和氯化钙溶液,振荡、静置、分液,目的是
③向所得有机层中加入无水硫酸钠,过滤。加入无水硫酸钠的作用是
(6)最终得到乙酸乙酯19.6mL,则该实验中乙酸乙酯的产率为
22-23高三上·山东青岛·阶段练习


