解答题-工业流程题 适中0.65 引用1 组卷216
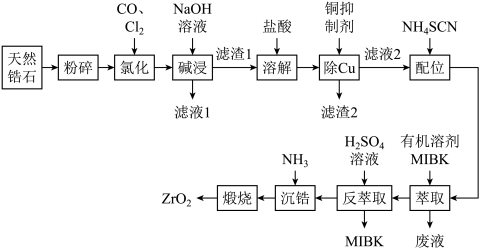
ZrO2是重要的耐高温材料,可用作陶瓷遮光剂和良好的催化剂。天然锆石的主要成分是ZrSiO4,另外还常含有Fe、Al、Cu的氧化物等杂质。工业上以天然锆石为原料制备ZrO2的工艺流程如图:
已知:(i)加热氯化过程中ZrSiO4生成ZrCl4、SiCl4等;ZrCl4易溶于水,400℃时升华;
(ii)常用的铜抑制剂为NaCN,它可与重金属离子生成沉淀,如Cu(CN)2。
(iii)“配合”生成的Fe(SCN)3难溶于MIBK(甲基异丁基酮,密度小于水),Zr(SCN)4在水中的溶解度小于在MIBK中的溶解度。
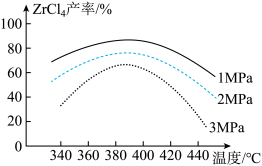
(1)“氯化”过程中,ZrSiO4发生反应的化学方程式为____ ,若“氯化”温度过高会导致ZrCl4产率降低,原因是____ 。
(2)溶解时,加入盐酸量不宜过多的原因为____ 。
(3)流程中“萃取”与“反萃取”可以分离铁、富集锆,简述“萃取”的原理:____ 。
(4)为提高反萃取率,本实验分三次反萃取。请简述反萃取的操作过程:取一定体积萃取后的MIBK溶液加入分液漏斗中____ 得到Zr(SO4)2溶液。
(可选择试剂:约100mL1mol/LH2SO4溶液、约100mL3mol/LH2SO4溶液)
(5)用EDTA可快速测定反萃取液中锆的含量,其操作步骤如下:
①用移液管吸取10.00mL酸浸液于250mL锥形瓶中,加入约100mL水;
②以6mol•L-1的盐酸调节溶液pH在0~0.3,加入0.2g盐酸羟胺,加热煮沸;
③加入2滴二甲酚橙指示剂,趁热用0.02000mol•L-1EDTA标准溶液进行滴定,EDTA与ZrO2+按1︰1的比例进行螯合消耗EDTA14.30mL;
④至溶液由紫红色突变为亮黄色且30s保持不变色,即为终点。
根据相关数据,计算酸浸液中锆的含量(以ZrO2计)为____ mg•mL-1(保留两位小数)。

已知:(i)加热氯化过程中ZrSiO4生成ZrCl4、SiCl4等;ZrCl4易溶于水,400℃时升华;
(ii)常用的铜抑制剂为NaCN,它可与重金属离子生成沉淀,如Cu(CN)2。
(iii)“配合”生成的Fe(SCN)3难溶于MIBK(甲基异丁基酮,密度小于水),Zr(SCN)4在水中的溶解度小于在MIBK中的溶解度。
(1)“氯化”过程中,ZrSiO4发生反应的化学方程式为
(2)溶解时,加入盐酸量不宜过多的原因为
(3)流程中“萃取”与“反萃取”可以分离铁、富集锆,简述“萃取”的原理:
(4)为提高反萃取率,本实验分三次反萃取。请简述反萃取的操作过程:取一定体积萃取后的MIBK溶液加入分液漏斗中
(可选择试剂:约100mL1mol/LH2SO4溶液、约100mL3mol/LH2SO4溶液)
(5)用EDTA可快速测定反萃取液中锆的含量,其操作步骤如下:
①用移液管吸取10.00mL酸浸液于250mL锥形瓶中,加入约100mL水;
②以6mol•L-1的盐酸调节溶液pH在0~0.3,加入0.2g盐酸羟胺,加热煮沸;
③加入2滴二甲酚橙指示剂,趁热用0.02000mol•L-1EDTA标准溶液进行滴定,EDTA与ZrO2+按1︰1的比例进行螯合消耗EDTA14.30mL;
④至溶液由紫红色突变为亮黄色且30s保持不变色,即为终点。
根据相关数据,计算酸浸液中锆的含量(以ZrO2计)为
22-23高三上·江苏南通·阶段练习
类题推荐
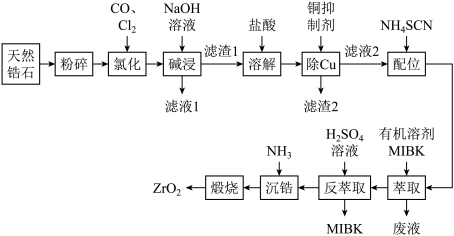
锆(Zr)产品广泛用于陶瓷、化工、电子等行业。我国是氯氧化锆的主要生产和出口国,产能占世界总产能的90%以上。用ZrC(杂质主要含C和SiO2)生产ZrOCl2·8H2O的工艺流程如图所示。

已知:
Ⅰ.Na2ZrO3不溶于水,易溶于无机酸。
Ⅱ.ZrOCl2·8H2O的溶解度随温度升高和酸度降低而升高。
回答下列问题:
(1)“碱熔”前,对ZrC进行机械粉碎的目的是_______ 。
(2)“碱熔”时,生成Na2ZrO3的化学方程式为_______ ,反应应在_______ (填标号)中进行。
A.陶瓷坩埚 B.石英坩埚 C.铁质坩埚 D.铝质坩埚
(3)“碱熔”过程中,配料比(NaOH与ZrC的质量比)对锆转化率的影响如下表所示:
最适宜的配料比为_______ 。
(4)“水洗”的目的是_______ 。
(5)“酸浸”时,滤渣中的Na2ZrO3转化为可溶性的ZrOCl2,以ZrO2+的形式存在于溶液中,该反应的离子方程式为_______ 。为减少产品损失,“操作”中的洗涤液最好选用_______ 。
(6)用EDTA可快速测定酸浸液中锆的含量,其操作步骤如下:
①用移液管吸取10.00 mL酸浸液于250 mL锥形瓶中,加入约100 mL水;
②以6 mol·L-1的盐酸调节溶液pH在0~0.3,加入0.2 g盐酸羟胺,加热煮沸;
③加入2滴二甲酚橙指示剂,趁热用0.02000 mol·L-1 EDTA标准溶液进行滴定,EDTA与ZrO2+按1︰1的比例进行螯合;
④至溶液由紫红色突变为亮黄色且30 s保持不变色,即为终点。
滴定过程中消耗EDTA的相关数据如下图所示:
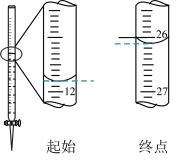
根据相关数据,计算酸浸液中锆的含量(以ZrO2计)为_______ mg·mL-1(保留两位小数)。

已知:
Ⅰ.Na2ZrO3不溶于水,易溶于无机酸。
Ⅱ.ZrOCl2·8H2O的溶解度随温度升高和酸度降低而升高。
回答下列问题:
(1)“碱熔”前,对ZrC进行机械粉碎的目的是
(2)“碱熔”时,生成Na2ZrO3的化学方程式为
A.陶瓷坩埚 B.石英坩埚 C.铁质坩埚 D.铝质坩埚
(3)“碱熔”过程中,配料比(NaOH与ZrC的质量比)对锆转化率的影响如下表所示:
| 配料比 | 1.0 | 1.1 | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 |
| 转化率/% | 84.02 | 89.07 | 91.97 | 93.73 | 99.06 | 99.12 | 99.11 |
(4)“水洗”的目的是
(5)“酸浸”时,滤渣中的Na2ZrO3转化为可溶性的ZrOCl2,以ZrO2+的形式存在于溶液中,该反应的离子方程式为
(6)用EDTA可快速测定酸浸液中锆的含量,其操作步骤如下:
①用移液管吸取10.00 mL酸浸液于250 mL锥形瓶中,加入约100 mL水;
②以6 mol·L-1的盐酸调节溶液pH在0~0.3,加入0.2 g盐酸羟胺,加热煮沸;
③加入2滴二甲酚橙指示剂,趁热用0.02000 mol·L-1 EDTA标准溶液进行滴定,EDTA与ZrO2+按1︰1的比例进行螯合;
④至溶液由紫红色突变为亮黄色且30 s保持不变色,即为终点。
滴定过程中消耗EDTA的相关数据如下图所示:

根据相关数据,计算酸浸液中锆的含量(以ZrO2计)为
锆产品广泛用于陶瓷、化工、电子等行业。我国是氧氯化锆的主要生产和出口国,产能占世界总产能的 以上。用
以上。用 (杂质主要含C和
(杂质主要含C和 )生产ZrOCl2·8H2O的工艺流程如图所示:
)生产ZrOCl2·8H2O的工艺流程如图所示:
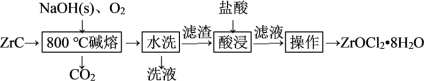
已知:Ⅰ.Na2ZrO3不溶于水,易溶于无机酸。
Ⅱ.ZrOCl2·8H2O的溶解度随温度升高和酸度降低而升高。
回答下列问题:
(1)“碱熔”前,对ZrC进行机械粉碎的目的是___________ 。
(2)“碱熔”时,固体 与ZrC的混合物应放在
与ZrC的混合物应放在___________ 质坩埚中进行煅烧。煅烧过程中,生成Na2ZrO3的化学方程式为___________ 。“碱熔”过程中,配料比 与
与 的质量比
的质量比 对锆转化率的影响如表。最适宜的配料比为
对锆转化率的影响如表。最适宜的配料比为___________ 。
(3)“水洗”的目的是___________ 。
(4)“酸浸”时,滤渣中的Na2ZrO3转化为可溶性的ZrOCl2,以ZrO2+的形式存在于溶液中,其离子方程式为___________ 。
(5)用EDTA可快速测定酸浸液中锆的含量,其操作步骤如下:
①用移液管吸取 酸浸液于
酸浸液于 锥形瓶中,加水
锥形瓶中,加水 ;
;
②以 的盐酸调节溶液
的盐酸调节溶液 范围在ZrO2+,加
范围在ZrO2+,加 盐酸羟胺,加热煮沸;
盐酸羟胺,加热煮沸;
③加 滴二甲酚橙,趁热用
滴二甲酚橙,趁热用 的EDTA标准溶液进行滴定,EDTA与ZrO2+按
的EDTA标准溶液进行滴定,EDTA与ZrO2+按 的比例进行螯合;
的比例进行螯合;
④直至溶液由紫红色变为亮黄色且 保持不变,即为终点。滴定过程中消耗
保持不变,即为终点。滴定过程中消耗 的相关数据如图。
的相关数据如图。
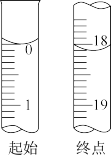
请根据相关数据,计算酸浸液中锆的含量 以
以 计
计 为
为 ___________ mg·mL-1保留两位小数 。
。
(6)为减少产品损失,“操作”中的洗涤液最好选用___________ 。
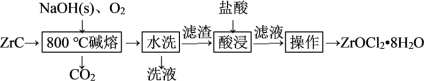
已知:Ⅰ.Na2ZrO3不溶于水,易溶于无机酸。
Ⅱ.ZrOCl2·8H2O的溶解度随温度升高和酸度降低而升高。
回答下列问题:
(1)“碱熔”前,对ZrC进行机械粉碎的目的是
(2)“碱熔”时,固体
| 配料比 | 1.0 | 1.1 | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 |
| 转化率/% | 84.02 | 89.07 | 91.97 | 93.73 | 99.06 | 99.12 | 99.11 |
(3)“水洗”的目的是
(4)“酸浸”时,滤渣中的Na2ZrO3转化为可溶性的ZrOCl2,以ZrO2+的形式存在于溶液中,其离子方程式为
(5)用EDTA可快速测定酸浸液中锆的含量,其操作步骤如下:
①用移液管吸取
②以
③加
④直至溶液由紫红色变为亮黄色且

请根据相关数据,计算酸浸液中锆的含量
(6)为减少产品损失,“操作”中的洗涤液最好选用
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网