解答题-原理综合题 适中0.65 引用1 组卷296
自然界是各类物质相互依存、各种变化相互制约的复杂平衡体系,水溶液中的离子平衡是其中一个重要方面。请根据所学知识,回答下列问题。
(1)某温度下,0.1mol/L的盐酸中水电离出的 ,该温度下将
,该温度下将 的NaOH溶液与
的NaOH溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的
_______ 。
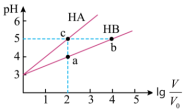
(2)常温下将pH均为3,体积均为 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随 的变化如图所示。
的变化如图所示。
①a、b、c三点水的电离程度_______ (用“>”、“=”、“<”填空)。
②常温下,取上述pH均为3的HA和HB溶液各100mL,向其中分别加入足量的Zn粒,反应结束时HA中产生氢气的物质的量为 ,HB溶液中产生氢气的物质的量为
,HB溶液中产生氢气的物质的量为 ,则
,则
_______  (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。
(3)查阅资料获得25℃时部分弱电解质的电离平衡常数数据:
①KSCN溶液呈弱碱性,用离子方程式解释原因_______ 。
② 溶液的水解平衡常数
溶液的水解平衡常数
_______ (保留两位有效数字)。
③同浓度的NaF溶液和 溶液相比,
溶液相比,
后者溶液中
_______ 前者溶液中 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。
④现有25℃时等浓度的5种溶液:
A. B.
B. C.
C. D.
D. E.
E.
这5种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:_______ (填字母)。
(1)某温度下,0.1mol/L的盐酸中水电离出的
(2)常温下将pH均为3,体积均为

①a、b、c三点水的电离程度
②常温下,取上述pH均为3的HA和HB溶液各100mL,向其中分别加入足量的Zn粒,反应结束时HA中产生氢气的物质的量为
(3)查阅资料获得25℃时部分弱电解质的电离平衡常数数据:
| 化学式 | HF | HClO | HSCN | |||
| 电离平衡常数 | 0.13 |
②
③同浓度的NaF溶液和
后者溶液中
④现有25℃时等浓度的5种溶液:
A.
这5种溶液中
22-23高二上·湖北武汉·阶段练习
类题推荐
自然界是各类物质相互依存、各种变化相互制约的复杂平衡体系,水溶液中的离子平衡是其中一个重要方面。请根据所学知识,回答下列问题。
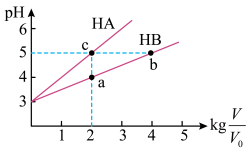
(1)常温下将 均为3,体积均为
均为3,体积均为 的
的 和
和 溶液,分别加水稀释至体积V,
溶液,分别加水稀释至体积V, 随
随 的变化如图所示。
的变化如图所示。
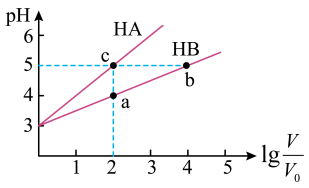
①a、b、c三点水的电离程度大小关系___________ (用“>”、“=”、“<”填空)。
②常温下,取上述 均为3的
均为3的 和
和 溶液各
溶液各 ,向其中分别加入足量的
,向其中分别加入足量的 粒,反应结束时
粒,反应结束时 中产生氢气的物质的量为
中产生氢气的物质的量为 ,
, 溶液中产生氢气的物质的量为
溶液中产生氢气的物质的量为 ,则
,则
___________  (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。
(2)氰化钠 是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢
是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢 。
。 能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表所示:
能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表所示:
① 溶液呈弱碱性,请用离子方程式解释原因
溶液呈弱碱性,请用离子方程式解释原因___________ 。
②室温下, 溶液的水解平衡常数
溶液的水解平衡常数
___________ (保留两位有效数字)。
③向 溶液中通入少量
溶液中通入少量 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
④同浓度的 溶液和
溶液和 溶液相比,溶液中
溶液相比,溶液中
___________  (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。
(1)常温下将

①a、b、c三点水的电离程度大小关系
②常温下,取上述
(2)氰化钠
弱酸 | |||
电离平衡常数(25℃) |
①
②室温下,
③向
④同浓度的
I.现有pH=2的醋酸(甲)和pH=2的盐酸(乙)
(1)常温下,取甲、乙两溶液各100mL,向其中分别加入适量的锌粒,反应后两溶液的pH均为4,设甲中加入的Zn质量为m1,乙中加入的Zn质量为m2,则m1_____ m2 (填“>”“<”或“=”)。
(2)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)______ (填“大于”“小于”或“等于”)V(乙)。
II..电离平衡常数是衡量弱电解质电离程度大小的量。
(3)25 ℃时某NaCN溶液的pH=10,该溶液显碱性的原因:______ (用离子方程式表示).
(4)25 ℃时某NaAc溶液的pH=10,该溶液中由水电离出的c(H+)=______ mol/L
(5)25 ℃时,有pH相同的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的物质的量浓度由大到小的顺序为______ (填序号)。
III.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液
的pH如下表:
请回答:
(6)由A组中的数据,可知A-的水解平衡常数约为_________
(7)B组中,若c=amol/L则常温下HA的电离常数为______________ (用含a的表达式表示)。
(1)常温下,取甲、乙两溶液各100mL,向其中分别加入适量的锌粒,反应后两溶液的pH均为4,设甲中加入的Zn质量为m1,乙中加入的Zn质量为m2,则m1
(2)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)
II..电离平衡常数是衡量弱电解质电离程度大小的量。
| 化学式 | 电离平衡常数(25 ℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(3)25 ℃时某NaCN溶液的pH=10,该溶液显碱性的原因:
(4)25 ℃时某NaAc溶液的pH=10,该溶液中由水电离出的c(H+)=
(5)25 ℃时,有pH相同的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的物质的量浓度由大到小的顺序为
III.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液
的pH如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| A | 0.1 | 0.1 | pH=9 |
| B | c | 0.2 | pH=7 |
请回答:
(6)由A组中的数据,可知A-的水解平衡常数约为
(7)B组中,若c=amol/L则常温下HA的电离常数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网