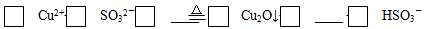解答题-实验探究题 适中0.65 引用1 组卷83
某实验小组为探究CuSO4与Na2SO3反应后的产物,做如下探究实验。
【查阅资料】
①Cu2O为砖红色固体,不溶于水;
②Cu2SO3为黄色固体,不溶于水;
③[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
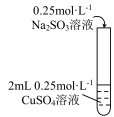
实验1:①向2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃ 2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol∙L-1的Na2SO3溶液中滴加0.2mol∙L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)S元素在元素周期表中的位置为_______ 。N、O、S三种元素原子的简单离子半径由大到小的顺序为_______ (用离子符号表示)。
(2)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:_______ 。
(3)经检验,实验2所得溶液中有大量 、
、 生成。该实验中Cu2+表现
生成。该实验中Cu2+表现_______ 性,写出该实验中反应的离子方程式:_______ 。
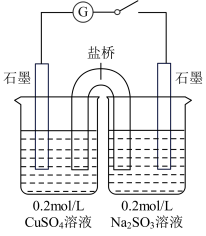
(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做_______ (填“正”或“负”)极,右侧烧杯中发生反应的电极反应式为_______ 。设计实验检验右侧烧杯中生成的阴离子,写出具体操作、现象和结论:_______ 。
【查阅资料】
①Cu2O为砖红色固体,不溶于水;
②Cu2SO3为黄色固体,不溶于水;
③[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
实验1:①向2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃ 2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol∙L-1的Na2SO3溶液中滴加0.2mol∙L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)S元素在元素周期表中的位置为
(2)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:
(3)经检验,实验2所得溶液中有大量
(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做

22-23高三上·河南安阳·阶段练习
类题推荐
某学习小组探究FeCl3溶液与Na2S溶液在某种条件下的反应。
实验Ⅰ
已知:FeS、Fe2S3均为黑色固体,难溶于水。
(1)用化学用语解释Na2S溶液呈碱性的原因___________ 。
(2)小组同学们试管b中黑色沉淀的提出猜想
猜想1::黑色沉淀是Fe2S3
猜想2::黑色沉淀是FeS
①针对猜想1,甲同学根据Na2S溶液呈碱性,推测试管b中黑色沉淀除Fe2S3外,还可能存在Fe(OH)3,补充实验II如下:
②甲同学继续查找数据:Ksp[Fe2S3]=1.0×10-88,Ksp[Fe(OH)3]=1.1×10-36,设计实验III:向Fe(OH)3中加入过量pH=12.5的0.1mol·L-1Na2S溶液,观察到的现象是沉淀颜色由___________ ,该现象对应的离子方程式为___________ 。
③针对猜想2,乙同学推测,若猜想2成立,应该还有S生成。写出该同学推测所依据的离子方程式___________ 。乙同学继续检验:进行实验并获取证据:取试管b中黑色沉淀,用水多次洗涤后,___________ ,确认黑色沉淀中无S单质,猜想2不成立。
(已知:Ksp(FeS)=1.59×10-19;H2S:Ka1=9.5×10-8,Ka2=1.3×10-14)
(3)丙同学利用电化学原理继续进行探究
丙同学依据实验IV得出结论:pH=1的0.1mol·L-1FeCl3溶液与pH=12.5的0.1mol·L-1Na2S溶液___________ (填“能”或“不能”)发生氧化还原反应。
(4)综合以上研究,从反应原理角度分析试管b中黑色沉淀是Fe2S3而不是FeS的原因:___________ 。
实验Ⅰ

已知:FeS、Fe2S3均为黑色固体,难溶于水。
(1)用化学用语解释Na2S溶液呈碱性的原因
(2)小组同学们试管b中黑色沉淀的提出猜想
猜想1::黑色沉淀是Fe2S3
猜想2::黑色沉淀是FeS
①针对猜想1,甲同学根据Na2S溶液呈碱性,推测试管b中黑色沉淀除Fe2S3外,还可能存在Fe(OH)3,补充实验II如下:
| 编号 | 操作或过程 | 现象和结论 |
| 实验Ⅱ | 向 | 有红褐色溶液生成。试管b中黑色的Fe2S3可能影响Fe(OH)3红褐色的观察。 |
③针对猜想2,乙同学推测,若猜想2成立,应该还有S生成。写出该同学推测所依据的离子方程式
(已知:Ksp(FeS)=1.59×10-19;H2S:Ka1=9.5×10-8,Ka2=1.3×10-14)
(3)丙同学利用电化学原理继续进行探究
| 编号 | 装置 | 操作及现象 |
| 实验IV |  | ①电流计指针有微弱偏转 ②2分钟后,取左侧烧杯溶液,滴加K3[Fe(CN)6]溶液,有少量蓝色沉淀;2小时后,右侧烧杯有黄色浑浊产生,再取左侧烧杯溶液,滴加K3[Fe(CN)6]溶液,有大量蓝色沉淀。 |
(4)综合以上研究,从反应原理角度分析试管b中黑色沉淀是Fe2S3而不是FeS的原因:
Cu2O可用于制作船底防污漆,某学习小组探究制备Cu2O的方法。
【查阅资料】① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O Cu(SO3)23-(无色)
Cu(SO3)23-(无色)
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因_______ 。
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式:____ Cu2++ ____ SO32-+ ____ =____ Cu2O↓+ ____ + ____ HSO3-
【实验探究】
(3)证明ii中砖红色沉淀是Cu2O的实验方案是_______ 。
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是______ 。
(5)iii中砖红色沉淀消失的原因是_______ 。
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是_______ 。
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是_______ 、_______ 。
【查阅资料】① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式:
【实验探究】
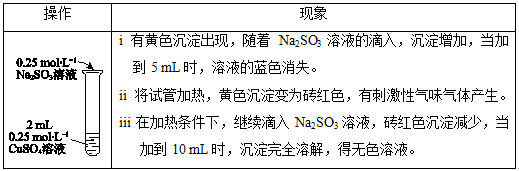
| 操作 | 现象 |
 | i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5 mL时,溶液的蓝色消失。 ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生。 iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10 mL时,沉淀完全溶解,得无色溶液。 |
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是
(5)iii中砖红色沉淀消失的原因是
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网