解答题-原理综合题 适中0.65 引用2 组卷233
回答下列问题:
(1)在一定体积的密闭容器中,进行化学反应 ,其化学平衡常数K和温度T的关系如表,回答下列问题:
,其化学平衡常数K和温度T的关系如表,回答下列问题:
①在700℃下,充入等物质的量的 和
和 ,平衡时
,平衡时 的转化率为
的转化率为_______ 。(保留三位有效数字)
②若830℃时,向容器中充入1molCO和4mol ,反应达到平衡后,其化学平衡常数K
,反应达到平衡后,其化学平衡常数K_______ (填“大于”“小于”或“等于”)1.0。
③若某温度时,体系中 、
、 、CO、
、CO、 的平衡浓度分别为
的平衡浓度分别为 、
、 、
、 、
、 ,则此时上述反应的温度
,则此时上述反应的温度_______ (填“大于”、“小于”或“等于”)1000℃。
(2) 催化重整有利于减少温室效应,反应方程式为:
催化重整有利于减少温室效应,反应方程式为: 。
。
催化重整时,还存在以下反应:
积碳反应:

消碳反应:

现在实验室中模拟 催化重整过程,请思考下列问题:
催化重整过程,请思考下列问题:
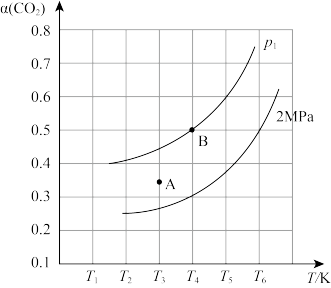
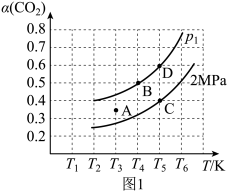
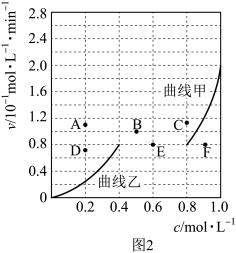
恒容密闭容器中,当投料比 时,
时, 平衡转化率(
平衡转化率( )与温度(T)、初始压强(p)的关系如图。
)与温度(T)、初始压强(p)的关系如图。

①当温度为 、压强为2MPa时,A点的
、压强为2MPa时,A点的
_______  (读“大于”、“小于”或“等于”)。
(读“大于”、“小于”或“等于”)。
②恒温恒容,初始压强为 时,起始时向密闭容器中加入1mol
时,起始时向密闭容器中加入1mol 和1mol
和1mol ,假设只发生反应
,假设只发生反应 。根据图中点
。根据图中点 ,计算该温度时反应的平衡常数
,计算该温度时反应的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
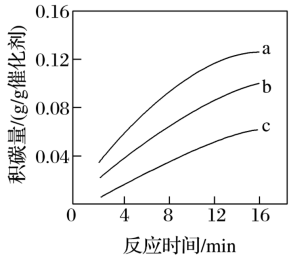
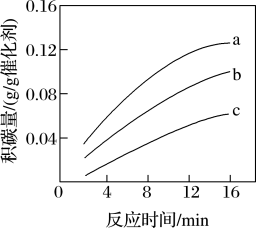
③分析可知;_______ 投料比 ,有助于减少积碳。(填“增大”或“减小”)
,有助于减少积碳。(填“增大”或“减小”)
(1)在一定体积的密闭容器中,进行化学反应
| T/℃ | 700 | 800 | 830 | 1000 |
| K | 0.64 | 0.9 | 1.0 | 1.7 |
②若830℃时,向容器中充入1molCO和4mol
③若某温度时,体系中
(2)
催化重整时,还存在以下反应:
积碳反应:
消碳反应:
现在实验室中模拟
恒容密闭容器中,当投料比

①当温度为
②恒温恒容,初始压强为
③分析可知;
22-23高二上·山东日照·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网