解答题-实验探究题 适中0.65 引用1 组卷109
某实验小组对 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。
【实验】
(1)配制 溶液时,先将
溶液时,先将 溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:
溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:_______ 。
(2)探究现象i产生的原因:
甲同学认为发生反应: ,进行实验证实。他取少量红褐色溶液于试管中,用一束光照射,在垂直于光束方向观察到
,进行实验证实。他取少量红褐色溶液于试管中,用一束光照射,在垂直于光束方向观察到_______ ;向试管中继续滴加1mol/L 溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是_______ (填化学式)。
(3)探究现象ii产生的原因:
①乙同学认为还发生了氧化还原反应,其离子方程式为_______ ;他取少许红褐色溶液于试管中,加入_______ ,有白色沉淀产生,证明产物中含有 。
。
②丙同学认为乙同学的实验不严谨,因为在上述过程中 可能被其它物质氧化。为了进一步确认
可能被其它物质氧化。为了进一步确认 被
被 氧化,丙同学设计的实验方案是
氧化,丙同学设计的实验方案是_______ 。
(4)综合上述结果,请从化学反应速率和化学反应限度角度解释,现象i和ii产生的原因为_______ 。
【实验】
| 装置 | 实验现象 |
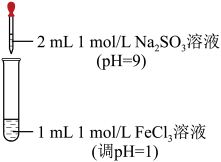 | 现象ⅰ:一开始溶液颜色加深,由棕黄色变为红褐色。 现象ⅱ:一段时间后溶液颜色变浅,变为浅黄色。 |
(2)探究现象i产生的原因:
甲同学认为发生反应:
(3)探究现象ii产生的原因:
①乙同学认为还发生了氧化还原反应,其离子方程式为
②丙同学认为乙同学的实验不严谨,因为在上述过程中
(4)综合上述结果,请从化学反应速率和化学反应限度角度解释,现象i和ii产生的原因为
22-23高三上·北京顺义·阶段练习
类题推荐
某实验小组研究 FeCl3溶液与 Na2SO3溶液之间的反应,进行如下实验探究
(1)配制 FeCl3溶液时,先将 FeCl3溶于浓盐酸,再稀释至指定浓度。结合化学用语说 明浓盐酸的作用:______ 。
(2)甲同学认为,上述实验在开始混合时观察到的现象不涉及氧化还原反应,实验 I中红褐色比 II 中略浅的原因是______ 。
(3)乙同学认为实验 II 可能发生了氧化还原反应,为了探究反应的产物做了实验 III和生成物检验。
① 取少量 Na2SO3溶液电极附近的混合液,加入______ ,产生白色沉淀,证明产生了 SO42-。
② 该同学又设计实验探究另一电极的产物,取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生____________________ ,证明产生了Fe2+。
(4)实验 III 发生反应的方程式是______ 。
(5)实验小组查阅资料:溶液中 Fe3+、 SO32-、OH-三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释实验 I、II 现象背后的原因可能是:______ 。
 | 编号 | 实验试剂及用量 | 开始混合时现象 | 30min时 | 3天后 |
I | 取1.0mol/LNa2SO3溶液2mL 滴加1.0mol/L FeCl3溶液2滴 | 溶液立即变为红褐色,比II中略浅 | 与开始混合时一致 | 溶液呈黄绿色 | |
II | 取1.0mol/L FeCl3溶液2mL 滴加1.0mol/L Na2SO3溶液2滴 | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
(1)配制 FeCl3溶液时,先将 FeCl3溶于浓盐酸,再稀释至指定浓度。结合化学用语说 明浓盐酸的作用:
(2)甲同学认为,上述实验在开始混合时观察到的现象不涉及氧化还原反应,实验 I中红褐色比 II 中略浅的原因是
(3)乙同学认为实验 II 可能发生了氧化还原反应,为了探究反应的产物做了实验 III和生成物检验。
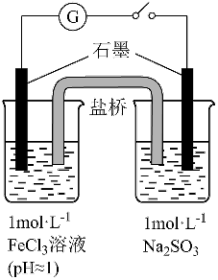 | 编号 | 实验操作及现象 |
III | 闭合开关后灵敏电流计指针发生偏转 |
① 取少量 Na2SO3溶液电极附近的混合液,加入
② 该同学又设计实验探究另一电极的产物,取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生
(4)实验 III 发生反应的方程式是
(5)实验小组查阅资料:溶液中 Fe3+、 SO32-、OH-三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释实验 I、II 现象背后的原因可能是:
某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
【甲同学的实验】
(1)配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。结合化学用语说明浓盐酸的作用:。
(2)甲同学探究实验I的电极产物______________ 。
①取少量Na2SO3溶液电极附近的混合液,加入______________ ,产生白色沉淀,证明产生了 。
。
②该同学又设计实验探究另一电极的产物,其实验方案为______________ 。
(3)实验I中负极的电极反应式为______________ 。
【乙同学的实验】
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3
 Fe(OH)3 +3SO2;②
Fe(OH)3 +3SO2;②______________ 。
(5)查阅资料:溶液中Fe3+、 、OH-三种微粒会形成红色配合物并存在如下转化:
、OH-三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________ 。
(6)解释30 min后上层溶液又变为浅红色的可能原因:______________ 。
【实验反思】
(7)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和有关(写出两条)______________ 。
【甲同学的实验】
| 装置 | 编号 | 试剂X | 实验现象 |
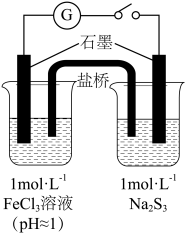 | I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
| II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(2)甲同学探究实验I的电极产物
①取少量Na2SO3溶液电极附近的混合液,加入
②该同学又设计实验探究另一电极的产物,其实验方案为
(3)实验I中负极的电极反应式为
【乙同学的实验】
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
| 装置 | 编号 | 反应时间 | 实验现象 |
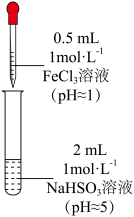 | III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
| 1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | ||
| 30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
① Fe3++3
(5)查阅资料:溶液中Fe3+、

从反应速率和化学平衡两个角度解释1~30 min的实验现象:
(6)解释30 min后上层溶液又变为浅红色的可能原因:
【实验反思】
(7)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和有关(写出两条)
某实验小组对 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。
已知:① 极易水解,在
极易水解,在 时已经完全沉淀为
时已经完全沉淀为 。
。
②铁氰化钾的化学式为 ,用于检验
,用于检验 ,遇
,遇 离子产生蓝色沉淀。
离子产生蓝色沉淀。
【实验1】
(1)用方程式解释 溶液显碱性的原因
溶液显碱性的原因________ 。配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用________ 。
(2)探究现象ⅰ产生的原因:
①甲同学认为发生反应: ;他取少量红褐色溶液于试管中,继续滴加
;他取少量红褐色溶液于试管中,继续滴加 溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是______ (填化学式)。
②乙同学认为 与
与 之间仅发生氧化还原反应,其离子方程式为
之间仅发生氧化还原反应,其离子方程式为________ ;该说法是否合理,为什么?_______ 。
③丙同学认为前两位同学所说反应均有发生,他取少许红褐色溶液于试管中,加入______ ,有白色沉淀产生,证明产物中含有 ,说明
,说明 与
与 之间发生了氧化还原反应。
之间发生了氧化还原反应。
④丁同学认为丙同学的实验不严谨,因为_______ 。为了进一步确认 被氧化的原因,丁同学设计了实验2。
被氧化的原因,丁同学设计了实验2。
【实验2】
用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。
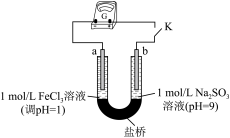
(3)实验2中正极的电极反应式为________ 。丁同学又用铁氰化钾溶液检验正极的产物,观察到有蓝色沉淀产生。他得出的结论是________ 。
(4)综合上述结果,请从平衡移动角度解释现象ⅱ产生的原因:_________ 。
已知:①
②铁氰化钾的化学式为
【实验1】
| 装置 | 实验现象 |
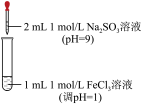 | 现象ⅰ:一开始溶液颜色加深,由棕黄色变为红褐色。 现象ⅱ:一段时间后溶液颜色变浅,变为浅黄色。 |
(1)用方程式解释
(2)探究现象ⅰ产生的原因:
①甲同学认为发生反应:
②乙同学认为
③丙同学认为前两位同学所说反应均有发生,他取少许红褐色溶液于试管中,加入
④丁同学认为丙同学的实验不严谨,因为
【实验2】
用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。

(3)实验2中正极的电极反应式为
(4)综合上述结果,请从平衡移动角度解释现象ⅱ产生的原因:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


