解答题-原理综合题 适中0.65 引用1 组卷277
我国科学家开发铜催化剂实现由N,N-二甲基甲酰胺 ,简称DMF]制备三甲胺:
,简称DMF]制备三甲胺:
 。
。
(1)在上述反应中,每生成1g气态水,放出_______ kJ的热量。
(2)在铜催化剂表面发生上述反应的历程如图所示(催化剂表面吸附物种用“*”表示)。
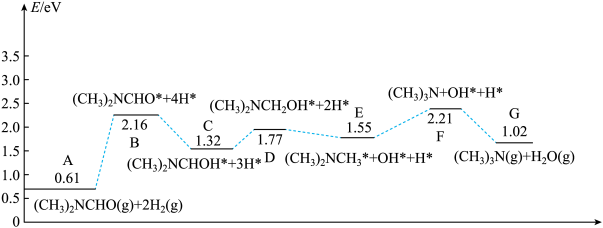
①下列分步反应中,能垒最大的是_______ (填标号)。
a.A→B b.C→D c.F→G
②A→B中,催化剂吸附放出的总能量_______ (填“大于”、“小于”或“等于”)断裂共价键吸收的总能量。
③D→E的化学方程式为_______ 。
(3)向体积相等的I、II两个恒容密闭容器中分别充入1mol DMF(g)和 发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
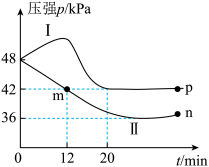
①容器I中为_______ (填“绝热”或“恒温”)过程。判断的依据是_______ 。
②在容器II中,0~12min内 分压变化速率为
分压变化速率为_______  。
。
③n点时反应的平衡常数
_______  。(提示:用分压计算的平衡常数为
。(提示:用分压计算的平衡常数为 ,分压等于总压×物质的量分数)
,分压等于总压×物质的量分数)
(1)在上述反应中,每生成1g气态水,放出
(2)在铜催化剂表面发生上述反应的历程如图所示(催化剂表面吸附物种用“*”表示)。

①下列分步反应中,能垒最大的是
a.A→B b.C→D c.F→G
②A→B中,催化剂吸附放出的总能量
③D→E的化学方程式为
(3)向体积相等的I、II两个恒容密闭容器中分别充入1mol DMF(g)和

①容器I中为
②在容器II中,0~12min内
③n点时反应的平衡常数
22-23高三上·广东湛江·阶段练习
类题推荐
烟气中的H2S及SO2可采用绿色的化学方法处理。
(1)利用CaCO3吸收烟气中H2S包括:CaCO3的分解、H2S的吸收与CaS的生成以及CaS的氧化。
①高温下反应CaCO3(s)=CaO(s)+CO2(g)能自发进行,则△H____ 0,△S____ 0(填“大于”或“小于”)。
②恒温恒容密闭容器中进行吸收H2S反应为CaO(s)+H2S(g)=CaS(s)+H2O(g),能说明该反应已达到平衡状态的是____ (填字母编号)。
A.气体的总压强不再随时间变化 B.单位时间内断裂H—S与生成H—O键数相等
C.气体的密度不再随时间变化 D.气体的分压 不再随时间变化
不再随时间变化
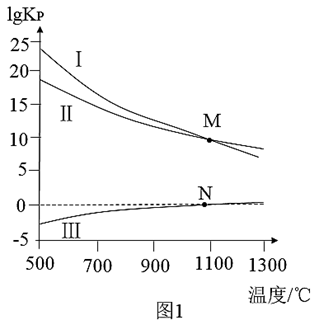
③CaS的氧化涉及如下反应:
(Ⅰ) CaS(s)+O2(g)
CaS(s)+O2(g)
 CaSO4(s) ∆H1
CaSO4(s) ∆H1
(Ⅱ) CaS(s)+O2(g)
CaS(s)+O2(g)
 CaO(s)+
CaO(s)+ SO2(g) ∆H2
SO2(g) ∆H2
(Ⅲ)CaSO4(s)+ CaS(s)
CaS(s)
 CaO(s)+
CaO(s)+ SO2(g) ∆H3
SO2(g) ∆H3
在恒压(总压为akPa)密闭容器中反应时,各反应的lgKp(Kp为以分压表示的平衡常数)与温度的关系如图1所示,由图可知:∆H>0的反应是____ (填标号);∆H3=____ (用∆H1、∆H2表示);N点时,分压p(SO2)=____ kPa,M点时,分压p(O2)=____ kPa。
(2)CO还原法处理SO2:2CO(g)+SO2(g)=S(l)+2CO2(g) △H=-37kJ/mol。向两个密闭容器中分别充入4molCO和2molSO2,在不同温度和压强下(物质状态未发生改变)发生上述反应,SO2的平衡转化率如表1所示,其中α1>α2,则T1____ T2(填“大于”、“小于”或“等于”),判断的理由是____ 。
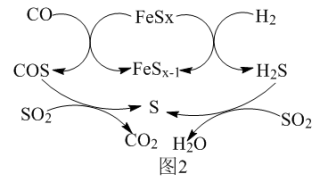
(3)FeSx催化水煤气(CO、H2)还原SO2的反应过程如图2所示。下列说法合理的是____ (填字母编号)。
(1)利用CaCO3吸收烟气中H2S包括:CaCO3的分解、H2S的吸收与CaS的生成以及CaS的氧化。
①高温下反应CaCO3(s)=CaO(s)+CO2(g)能自发进行,则△H
②恒温恒容密闭容器中进行吸收H2S反应为CaO(s)+H2S(g)=CaS(s)+H2O(g),能说明该反应已达到平衡状态的是
A.气体的总压强不再随时间变化 B.单位时间内断裂H—S与生成H—O键数相等
C.气体的密度不再随时间变化 D.气体的分压
③CaS的氧化涉及如下反应:
(Ⅰ)
(Ⅱ)
(Ⅲ)CaSO4(s)+
在恒压(总压为akPa)密闭容器中反应时,各反应的lgKp(Kp为以分压表示的平衡常数)与温度的关系如图1所示,由图可知:∆H>0的反应是

(2)CO还原法处理SO2:2CO(g)+SO2(g)=S(l)+2CO2(g) △H=-37kJ/mol。向两个密闭容器中分别充入4molCO和2molSO2,在不同温度和压强下(物质状态未发生改变)发生上述反应,SO2的平衡转化率如表1所示,其中α1>α2,则T1
| 压强 | p | 2p |
| 温度 | T1 | T2 |
| SO2的平衡转化率α | α1 | α2 |

| A.COS和H2S为中间产物 | B.生成S的反应中,S均为还原产物 |
| C.可能存在反应FeSx-1+S=FeSx | D.寻找更高效的催化剂可以提高S单质的平衡转化率 |
减缓全球变暖的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛,反应的热化学方程式为CO2(g)+2H2(g) HCHO(g)+H2O(g) ΔH。请回答下列问题:
HCHO(g)+H2O(g) ΔH。请回答下列问题:
(1)已知:①HCHO(g)+O2(g) CO2(g)+H2O(g) ΔH1=-480 kJ·mol-1。
CO2(g)+H2O(g) ΔH1=-480 kJ·mol-1。
②相关化学键的键能数据如表所示。
则ΔH=___________ 。
(2)一定条件下,将n(CO2)∶n(H2)=1∶2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g) HCHO(g)+H2O(g)。
HCHO(g)+H2O(g)。
①下列能说明反应已经达到平衡状态的是___________ (填字母,下同)。
a.容器内气体密度保持不变
b.H2O(g)的体积分数保持不变
c.该反应的平衡常数保持不变
d.混合气体的平均相对分子质量保持不变
e. CO2与H2的物质的量之比等于1:2,且始终保持不变
②下列措施既能提高H2的平衡转化率又能增大反应速率的是___________ 。
a.升高温度 b.使用高效催化剂
c.缩小容器体积 d.扩大容器体积
(3)实验室在2 L恒容密闭容器中模拟上述合成HCHO的实验。T1℃时,将相同条件下体积比为1∶2的CO2和H2的混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
①已知v(B)= ,则0~10 min内,用H2的压强变化表示的该反应的平均反应速率为
,则0~10 min内,用H2的压强变化表示的该反应的平均反应速率为___________ kPa·min-1。
②T1℃时,该反应的平衡常数Kp=___________ (列出计算式即可,Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数)。
(4)T2℃时,向2 L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2 kPa,反应达到平衡时,HCHO(g)的分压[p(HCHO)]与起始时 的关系如图所示。
的关系如图所示。
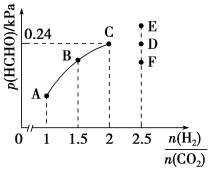
①当 =2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的平衡转化率将
=2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的平衡转化率将___________ (填“增大”“减小”或“不变”)。
②当 =2.5时,达到平衡状态后,HCHO的分压可能对应图像中的点
=2.5时,达到平衡状态后,HCHO的分压可能对应图像中的点___________ (填“D”“E”或“F”)。
③A、B、C三点CO2的转化率大小关系___________ 。
(1)已知:①HCHO(g)+O2(g)
②相关化学键的键能数据如表所示。
| 化学键 | O=O | H-H | O-H |
| 键能/(kJ·mol-1) | 497.3 | 436 | 462.8 |
(2)一定条件下,将n(CO2)∶n(H2)=1∶2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)
①下列能说明反应已经达到平衡状态的是
a.容器内气体密度保持不变
b.H2O(g)的体积分数保持不变
c.该反应的平衡常数保持不变
d.混合气体的平均相对分子质量保持不变
e. CO2与H2的物质的量之比等于1:2,且始终保持不变
②下列措施既能提高H2的平衡转化率又能增大反应速率的是
a.升高温度 b.使用高效催化剂
c.缩小容器体积 d.扩大容器体积
(3)实验室在2 L恒容密闭容器中模拟上述合成HCHO的实验。T1℃时,将相同条件下体积比为1∶2的CO2和H2的混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
②T1℃时,该反应的平衡常数Kp=
(4)T2℃时,向2 L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2 kPa,反应达到平衡时,HCHO(g)的分压[p(HCHO)]与起始时

①当
②当
③A、B、C三点CO2的转化率大小关系
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




