解答题-实验探究题 适中0.65 引用1 组卷145
金属及其化合物在人类生产、生活中发挥着重要作用。
(1)中国四大发明之一的指南针由天然磁石制成的,其主要成分是_______(填字母)。
(2)在钢铁厂的生产中,炽热的铁水注入模具之前,必须对模具进行充分的干燥处理,不得留有水,原因是_______ (用化学方程式表示)。
(3)铝制餐具不宜长期存放酸性、碱性或咸的食物,其中Al和NaOH溶液反应的离子方程式是_______
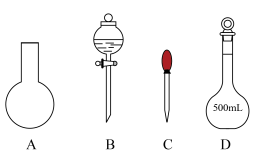
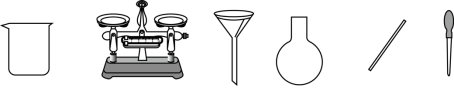
(4)“84消毒液”有效成分是NaClO。某次实验需要使用900mL0.2 mol·L-1的NaClO溶液,欲用NaClO固体配制该溶液,实验中需要称量_______ gNaClO晶体,下图不需要的仪器是_______ (写出仪器名称),若定容时仰视刻度线,则所配溶液浓度_______ 0.2 mol·L-1 (填“>”或“<”)
(5)双氧水能使酸性高锰酸钾溶液褪色,请完成以下相关反应的离子方程式:_______ 。
______ +_____H2O2+______=______Mn2++_____H2O+______
+_____H2O2+______=______Mn2++_____H2O+______
(1)中国四大发明之一的指南针由天然磁石制成的,其主要成分是_______(填字母)。
| A.Fe | B.FeO | C.Fe3O4 | D.Fe2O3 |
(3)铝制餐具不宜长期存放酸性、碱性或咸的食物,其中Al和NaOH溶液反应的离子方程式是
(4)“84消毒液”有效成分是NaClO。某次实验需要使用900mL0.2 mol·L-1的NaClO溶液,欲用NaClO固体配制该溶液,实验中需要称量

(5)双氧水能使酸性高锰酸钾溶液褪色,请完成以下相关反应的离子方程式:
______
22-23高三上·辽宁·阶段练习
知识点:铝与强碱溶液反应配制一定物质的量浓度的溶液的步骤、操作配制一定物质的量浓度的溶液实验的误差分析配制一定物质的量浓度的溶液实验的仪器 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
实验室中需要配制0.2mol/L的CuSO4溶液480mL,请回答下面问题。
(1)用天平称取CuSO4•5H2O晶体的质量是_____ g。
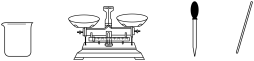
(2)完成上述实验,除需要如图所示的仪器外,还需要的玻璃仪器是_____ 。
(3)在使用胆矾配制溶液时,需要使用两次玻璃棒,作用是_____ 。
(4)下列实验操作会使配制的溶液浓度偏低的是_____ 。
(5)若用0.2mol/LCuSO4溶液配制250mL0.1mol/LCuSO4溶液,需要量取_____ mL0.2mol/LCuSO4。
(6)铜屑放入稀硫酸中不发生反应,向体系通入O2,铜屑可以逐渐溶解生成CuSO4,该反应的离子方程式为_____ 。
(7)某养殖场消毒液由CuSO4、Na2SO4、NaCl混合而成,已知部分离子浓度如表:
该消毒液c(Cu2+)=_____ 。
(1)用天平称取CuSO4•5H2O晶体的质量是
(2)完成上述实验,除需要如图所示的仪器外,还需要的玻璃仪器是

(3)在使用胆矾配制溶液时,需要使用两次玻璃棒,作用是
(4)下列实验操作会使配制的溶液浓度偏低的是
| A.容量瓶内有水,未经过干燥处理 |
| B.定容时,仰视刻度线 |
| C.转移溶液后的烧杯和玻璃棒未洗涤 |
| D.定容后液面超过刻度线,吸出一部分水 |
(6)铜屑放入稀硫酸中不发生反应,向体系通入O2,铜屑可以逐渐溶解生成CuSO4,该反应的离子方程式为
(7)某养殖场消毒液由CuSO4、Na2SO4、NaCl混合而成,已知部分离子浓度如表:
| 离子符号 | Na+ | SO | Cl- |
| c/mol•L-1 | 1.3 | 0.4 | 0.9 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网