解答题-原理综合题 适中0.65 引用1 组卷90
绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等物质对建设美丽中国具有重要意义。
(1)CO2与CH4经催化重整,制得合成气: CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知上述反应中相关的化学键键能数据如下:
则该反应的 ΔH=_______
(2)已知:
N2 (g) +2O2 (g) =2NO2 (g) ΔH = + 67.7kJ·mol-1
N2H4 (g) +O2 (g) =N2 (g) +2H2O (g) ΔH =-534.0kJ·mol-1
2NO2 (g) N2O4 (g) ΔH = -52.7kJ·mol-1
N2O4 (g) ΔH = -52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式_______
(3)在固定体积密闭容器中,进行如下化学反应: N2 (g) +3H2 (g) 2NH3 (g) ΔH <0,下列各项能说明该反应在一定温度下已达到平衡状态的是
2NH3 (g) ΔH <0,下列各项能说明该反应在一定温度下已达到平衡状态的是_______ (填字母)。
a. v (N2)正=3v (H2)逆
b.混合气体的密度保持不变
c.容器内压强保持不变
d.容器内N2、H2、NH3的浓度之比为1 :3 :2
e.N2和H2的转化率相等
f.体系中气体的平均摩尔质量不再改变
(4)以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
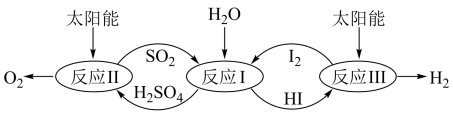
相关反应的热化学方程式为:
反应I: SO2(g)+ I2(g)+ 2H2O(1)= 2HI(aq) + H2SO4(aq); ΔH 1= - 213 kJ·mol-1
反应II: H2SO4(aq) = SO2(g) + H2O +1/2O2(g); ΔH 2= +327 kJ·mol-1
反应III:2HI(aq) =H2(g)+ I2(g); ΔH3 = +172 kJ·mol-l
下列说法不正确的是
(5)催化剂的研究一直 受到高度重视。催化剂参与化学过程,反应2SO2(g)+O2(g)  2SO3(g)通常用V2O5作催化剂,V2O5的催化循环机理可能为: V2O5氧化SO2时,自身被还原为VO2; VO2再被氧气氧化。写出该催化循环机理的两步化学方程式
2SO3(g)通常用V2O5作催化剂,V2O5的催化循环机理可能为: V2O5氧化SO2时,自身被还原为VO2; VO2再被氧气氧化。写出该催化循环机理的两步化学方程式_______ 、_______ 。
(1)CO2与CH4经催化重整,制得合成气: CH4(g)+CO2(g)
已知上述反应中相关的化学键键能数据如下:
| 化学键 | C- H | C=O | H-H | C |
| 键能/kJ·mol-l | a | b | c | d |
(2)已知:
N2 (g) +2O2 (g) =2NO2 (g) ΔH = + 67.7kJ·mol-1
N2H4 (g) +O2 (g) =N2 (g) +2H2O (g) ΔH =-534.0kJ·mol-1
2NO2 (g)
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式
(3)在固定体积密闭容器中,进行如下化学反应: N2 (g) +3H2 (g)
a. v (N2)正=3v (H2)逆
b.混合气体的密度保持不变
c.容器内压强保持不变
d.容器内N2、H2、NH3的浓度之比为1 :3 :2
e.N2和H2的转化率相等
f.体系中气体的平均摩尔质量不再改变
(4)以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:

相关反应的热化学方程式为:
反应I: SO2(g)+ I2(g)+ 2H2O(1)= 2HI(aq) + H2SO4(aq); ΔH 1= - 213 kJ·mol-1
反应II: H2SO4(aq) = SO2(g) + H2O +1/2O2(g); ΔH 2= +327 kJ·mol-1
反应III:2HI(aq) =H2(g)+ I2(g); ΔH3 = +172 kJ·mol-l
下列说法不正确的是
| A.该过程实现了太阳能到化学能的转化 |
| B.SO2和I2对总反应起到了催化剂的作用 |
| C.总反应的热化学方程式为: 2H2O(1)= 2H2(g)+O2(g); ΔH = +286 kJ ·mol-1 |
| D.该过程降低了水分解制氢反应的活化能,但总反应的ΔH不变 |
22-23高二上·四川·阶段练习
类题推荐
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。通过对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)已知:H2的燃烧热为285.8 kJ·mol-1 H2O(g)=H2O(l) ΔH=-44 kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+133 kJ/mol
①在催化剂存在下,H2还原NO2生成水蒸气和另一种无毒物质的热化学方程式为:___________________________________ 。
②反应2NO2(g )=N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。
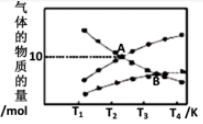
则A点时,NO2的转化率为_______________ 。
B点时,设容器的总压为a Pa,则平衡常数Kp为____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g) CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
①该反应ΔH_______ 0(填“>”、“<”或“=”)
②下列叙述能说明此反应达到平衡状态的是____________ 。(填字母)
a.混合气体的平均相对分子质量保持不变
b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
反应Ⅰ,前10min内的平均反应速率v(CH3OH)=____________ 。达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)____________ K(II)(填“>”、“<”或“=”);平衡时CH3OH的浓度c(I)____________ c(II)(填“>”、“<”或“=”)。
(1)已知:H2的燃烧热为285.8 kJ·mol-1 H2O(g)=H2O(l) ΔH=-44 kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+133 kJ/mol
①在催化剂存在下,H2还原NO2生成水蒸气和另一种无毒物质的热化学方程式为:
②反应2NO2(g )=N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。

则A点时,NO2的转化率为
B点时,设容器的总压为a Pa,则平衡常数Kp为
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)
 CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。①该反应ΔH
②下列叙述能说明此反应达到平衡状态的是
a.混合气体的平均相对分子质量保持不变
b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:| 反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
| 反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
| 10 min | 4.5 | ||||
| 20 min | 1 | ||||
| 30 min | 1 | ||||
| 反应Ⅱ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
反应Ⅰ,前10min内的平均反应速率v(CH3OH)=
“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g) S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
b.S(l)+2H2O(g) 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为__________________________________ 。
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g) CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
①前10min内的平均反应速率v(CO)=_______ ;在20min时,温度T2下,该反应的化学平衡常数为________________ 。
②若30min时升高温度,化学平衡常数值_______ (填:“增大“减小”“不变”)。
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_____________ (填两种措施即可)
④在恒温恒容下,下列可以判断CO(g)+2H2(g) CH3OH(g)反应达到平衡状态的
CH3OH(g)反应达到平衡状态的________ (填序号)。
a.2v正(H2)=v逆(CH3OH) b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2 d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g) 2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
则k1=____ , m =_____ , n =_____ 。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g)
 S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
S(l)+2CO2(g) △H1= - 37.4kJ·mol-1b.S(l)+2H2O(g)
 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1则CO和水蒸气完全反应生成H2和CO2的热化学方程式为
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g)
 CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:| 反应时间 | CO(mol) | H2(mol) | CH3OH(mol) |
| 0min | 2 | 4 | 0 |
| 10min | 2 | ||
| 20min | 0.2 |
①前10min内的平均反应速率v(CO)=
②若30min时升高温度,化学平衡常数值
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有
④在恒温恒容下,下列可以判断CO(g)+2H2(g)
 CH3OH(g)反应达到平衡状态的
CH3OH(g)反应达到平衡状态的a.2v正(H2)=v逆(CH3OH) b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2 d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g)
 2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。| 组别 | 起始浓度/mol·L-1 | 初始速率/ mol·L-1·S-1 | |
| NO | O2 | ||
| 1 | 0.02 | 0.0125 | 7.98×10-3 |
| 2 | 0.02 | 0.0250 | 15.96×10-3 |
| 3 | 0.04 | 0.0125 | 31.92×10-3 |
则k1=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网