解答题-原理综合题 较难0.4 引用2 组卷620
Ⅰ. 25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,电离平衡常数Ka_______ (填“增大”、“减小”或“不变”),H2CO3的一级电离平衡常数表达式为Ka1 =_______ 。
(2)下列四种离子结合H+能力最强的是_______(填字母)。
(3)下列方法中,可以使 溶液中
溶液中 电离程度增大的是_______。
电离程度增大的是_______。
(4)HClO与Na2CO3溶液反应的离子方程式_______ 。
(5)25℃时,向①NaClO溶液中通入少量CO2,发生反应的离子方程式为_______ 。
II.某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:
(6)该温度下水的Kw=_______ 。
(7)此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va:Vb=_______ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数Ka | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)一般情况下,当温度升高时,电离平衡常数Ka
(2)下列四种离子结合H+能力最强的是_______(填字母)。
| A. | B.ClO- | C.CH3COO- | D. |
| A.通入少量HCl气体 | B.加入少量冰醋酸 | C.加入少量醋酸钠固体 | D.加入少量水 |
(5)25℃时,向①NaClO溶液中通入少量CO2,发生反应的离子方程式为
II.某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:
(6)该温度下水的Kw=
(7)此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va:Vb=
22-23高二上·河北邯郸·阶段练习
类题推荐
25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)浓度均为0.1mol/L的CH3COOH、H2CO3、HC1O溶液,H+浓度最大的是_______ ,H3PO3的二级电离方程式为_______ ,Na2HPO3是_____ (填“正盐”或“酸式盐”)。
(2)写出下列反应的离子方程式。
①向HClO溶液中滴加少量Na2CO3溶液:__________ 。
②向NaClO溶液中通入过量CO2:_________ 。
(3)为了增大氯水的漂白性可加入_____ 。
A.NaOH B.HCl C. D.
D. E. CaCO3
E. CaCO3
(4)常温下,下列方法可以使0.1 mol·L-1 CH3COOH的电离程度增大的是_______。
(5)25 ℃时,向NaHCO3溶液中加入一定量的氨水,所得混合液的pH=8,则混合液中c( ):c(H2CO3)=
):c(H2CO3)=_______ (填数值)。
(6)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中, =
=_____ (填数值)。
(7)将一定浓度的氢氧化钠溶液加热,pH_____ (填“变大”“变小”或“不变”)。
(8)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是__ (填字母)。
A.c(H+) B. C.c(H+)∙c(OH﹣) D.
C.c(H+)∙c(OH﹣) D. E.
E.
| 化学式 | CH3COOH | H2CO3 | HClO | H3PO3 |
| 电离平衡常数 | 1.7×10﹣5 | K1=4×10-7 K2=5×10﹣11 | 3.0×10﹣8 | K1=8×10-3 K2=5×10﹣6 |
(1)浓度均为0.1mol/L的CH3COOH、H2CO3、HC1O溶液,H+浓度最大的是
(2)写出下列反应的离子方程式。
①向HClO溶液中滴加少量Na2CO3溶液:
②向NaClO溶液中通入过量CO2:
(3)为了增大氯水的漂白性可加入
A.NaOH B.HCl C.
(4)常温下,下列方法可以使0.1 mol·L-1 CH3COOH的电离程度增大的是_______。
| A.加入少量的稀盐酸 | B.加热溶液 | C.加水稀释 | D.加入少量冰醋酸 |
(5)25 ℃时,向NaHCO3溶液中加入一定量的氨水,所得混合液的pH=8,则混合液中c(
(6)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中,
(7)将一定浓度的氢氧化钠溶液加热,pH
(8)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是
A.c(H+) B.
25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,Ka_______ (填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是_______ (填字母)。
a.CO b.ClO- c.CH3COO- d.HCO
b.ClO- c.CH3COO- d.HCO
(3)下列反应不能发生的是_______ (填字母)。
a. CO +2CH3COOH=2CH3COO-+CO2↑+H2O
+2CH3COOH=2CH3COO-+CO2↑+H2O
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO +2HClO=CO2↑+H2O+2ClO-
+2HClO=CO2↑+H2O+2ClO-
d. 2ClO-+CO2+H2O=CO +2HClO
+2HClO
(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=_______ mol·L-1(填精确数值)。
(5)已知在25 ℃时Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.0×10-20
①25 ℃时,向0.02 mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为_______ 。
②25 ℃时,向浓度均为0.02 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成_______ 沉淀(填化学式);当两种沉淀共存时,c(Mg2+)/c(Cu2+)=_______ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka
(2)下列四种离子结合质子能力由大到小的顺序是
a.CO
(3)下列反应不能发生的是
a. CO
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO
d. 2ClO-+CO2+H2O=CO
(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=
(5)已知在25 ℃时Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.0×10-20
①25 ℃时,向0.02 mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为
②25 ℃时,向浓度均为0.02 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成
25℃时,三种酸的电离平衡常数如表:
回答下列问题:
(1)一般情况下,当温度升高时,Ka____ (填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是____ (填字母)。
a.CO b.ClO- c.CH3COO- d.HCO
b.ClO- c.CH3COO- d.HCO
(3)下列反应不能发生的是____ (填字母)。
a.CO +2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
+2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.CO +2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=CO
+2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=CO +2HClO
+2HClO
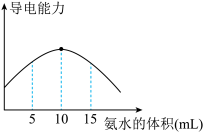
(4)现取20mLpH=3的CH3COOH溶液,加入0.2mol•L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为____ 。
(5)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。

稀释后,HX溶液中水电离出来的c(H+)____ (填>”、“=”或“<”,下同)醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸___ HX。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)一般情况下,当温度升高时,Ka
(2)下列四种离子结合质子能力由大到小的顺序是
a.CO
(3)下列反应不能发生的是
a.CO
c.CO
(4)现取20mLpH=3的CH3COOH溶液,加入0.2mol•L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为

(5)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。

稀释后,HX溶液中水电离出来的c(H+)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


