计算题 适中0.65 引用1 组卷420
减弱温室效应的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛,反应的热化学方程式为CO2(g)+2H2(g HCHO(g)+H2O(g) ΔH。实验室在2L密闭容器中进行模拟上述合成HCHO的实验。T1℃时,将体积比为1∶2的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
HCHO(g)+H2O(g) ΔH。实验室在2L密闭容器中进行模拟上述合成HCHO的实验。T1℃时,将体积比为1∶2的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
已知:v(B)= ,则反应开始10min内,用H2的压强变化表示该反应的平均反应速率为
,则反应开始10min内,用H2的压强变化表示该反应的平均反应速率为_____ kPa•min-1。
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
2022高三·全国·专题练习
类题推荐
减弱温室效应的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛(HCHO),反应的热化学方程式为CO2(g)+2H2(g)  HCHO(g)+H2O(g) ∆H。请回答下列问题:
HCHO(g)+H2O(g) ∆H。请回答下列问题:
(1)已知:①HCHO (g)+O2(g)=CO2(g)+H2O(g) ∆H1= - 480kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H2=-486kJ/mol
则由CO2和H2合成甲醛的热化学方程式为:_______ 。
(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g) HCHO (g)+H2O(g)。
HCHO (g)+H2O(g)。
①下列说明反应已经达到平衡状态的是_______ (填选项字母)。
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是_______ (填选项字母)。
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2L密闭容器中进行模拟上述合成甲醛(HCHO)的实验。T1℃时,将1molCO2和4molH2充入容器中,每隔一定时间测得容器内CO2的物质的量如表所示:
①反应开始10min内,H2的平均反应速率为_______ 。
②T1℃时,反应的平衡常数为K=_______ (保留小数点后两位)
③达到平衡时H2的转化率为_______
(1)已知:①HCHO (g)+O2(g)=CO2(g)+H2O(g) ∆H1= - 480kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H2=-486kJ/mol
则由CO2和H2合成甲醛的热化学方程式为:
(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)
①下列说明反应已经达到平衡状态的是
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2L密闭容器中进行模拟上述合成甲醛(HCHO)的实验。T1℃时,将1molCO2和4molH2充入容器中,每隔一定时间测得容器内CO2的物质的量如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| CO2的物质的量/mol | 1.00 | 0.60 | 0.46 | 0.32 | 0.20 | 0.20 | 0.20 |
①反应开始10min内,H2的平均反应速率为
②T1℃时,反应的平衡常数为K=
③达到平衡时H2的转化率为
减弱温室效应的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛,反应的热化学方程式为CO2(g)+2H2(g)⇌HCHO(g)+H2O(g)ΔH。
(1)已知:①HCHO(g)+O2(g)=CO2(g)+H2O(g)ΔH1=-480 kJ·mol-1;
②相关化学键的键能数据如表所示:
则CO2(g)+2H2(g)⇌HCHO(g)+H2O(g)ΔH=___________ 。
(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)⇌HCHO(g)+H2O(g)。
①下列说明反应已经达到平衡状态的是___________ (填选项字母)。
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是___________ (填选项字母)。
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2 L密闭容器中进行模拟上述合成HCHO的实验。T1℃时,将体积比为1:2的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
①已知:vp(B)=Δp(B)/Δt,则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为___________ kPa·min-1
②T1℃时,反应的平衡常数Kp的代数式为Kp=___________ kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数)。
(4)T2℃时,向体积为2 L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2kPa,反应达到平衡时,HCHO的分压与起始 的关系如图所示:
的关系如图所示:

①当 时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将
时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将___________ (填“增大”“减小”或“不变”)。
②当 时,达到平衡状态后,HCHO的分压可能是图象中的
时,达到平衡状态后,HCHO的分压可能是图象中的___________ 点(填“D”“E”或“F”)。
(1)已知:①HCHO(g)+O2(g)=CO2(g)+H2O(g)ΔH1=-480 kJ·mol-1;
②相关化学键的键能数据如表所示:
| 化学键 | O=O | H-H | O-H |
| 键能/kJ·mol-1 | 498 | 436 | 464 |
则CO2(g)+2H2(g)⇌HCHO(g)+H2O(g)ΔH=
(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)⇌HCHO(g)+H2O(g)。
①下列说明反应已经达到平衡状态的是
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2 L密闭容器中进行模拟上述合成HCHO的实验。T1℃时,将体积比为1:2的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
①已知:vp(B)=Δp(B)/Δt,则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为
②T1℃时,反应的平衡常数Kp的代数式为Kp=
(4)T2℃时,向体积为2 L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2kPa,反应达到平衡时,HCHO的分压与起始

①当
②当
减弱温室效应的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛,反应的热化学方程式为CO2(g)+2H2(g) HCHO(g)+H2O(g) ΔH。请回答下列问题:
HCHO(g)+H2O(g) ΔH。请回答下列问题:
(1)已知:①HCHO(g)+O2(g) CO2(g)+H2O(g) ΔH1=-480kJ·mol-1
CO2(g)+H2O(g) ΔH1=-480kJ·mol-1
②相关化学键的键能数据如表所示:
则CO2(g)+2H2(g) HCHO(g)+H2O(g) ΔH=
HCHO(g)+H2O(g) ΔH=_______ kJ·mol-1。
(2)一定条件下,将n(CO2)∶n(H2)=1∶2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g) HCHO(g)+H2O(g)。
HCHO(g)+H2O(g)。
①下列说明反应已经达到平衡状态的是_______ (填选项字母)。
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是_______ (填选项字母)。
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2L密闭容器中进行模拟上述合成HCHO的实验。T1℃时,将体积比为1∶2的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
①已知:v(B)= ,则反应开始10min内,用H2的压强变化表示该反应的平均反应速率为
,则反应开始10min内,用H2的压强变化表示该反应的平均反应速率为_______ kPa·min-1。
②T1℃时,反应的平衡常数的代数式Kp=_______ (Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数)。
(4)T2℃时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2kPa,反应达到平衡时,HCHO的分压与起始的 关系如图所示:
关系如图所示:
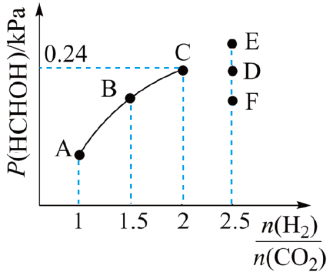
①当 =2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05kPa,则达到新平衡时,H2的转化率将
=2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05kPa,则达到新平衡时,H2的转化率将_______ (填“增大”“减小”或“不变”)。
②当 =2.5时,达到平衡状态后,HCHO的分压可能是图象中的点
=2.5时,达到平衡状态后,HCHO的分压可能是图象中的点_______ (填“D”“E”或“F”),原因为_______ 。
(1)已知:①HCHO(g)+O2(g)
②相关化学键的键能数据如表所示:
| 化学键 | O=O | H—H | O—H |
| 键能/(kJ·mol-1) | 498 | 436 | 464 |
(2)一定条件下,将n(CO2)∶n(H2)=1∶2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)
①下列说明反应已经达到平衡状态的是
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2L密闭容器中进行模拟上述合成HCHO的实验。T1℃时,将体积比为1∶2的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
②T1℃时,反应的平衡常数的代数式Kp=
(4)T2℃时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2kPa,反应达到平衡时,HCHO的分压与起始的

①当
②当
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


