解答题-原理综合题 适中0.65 引用1 组卷115
利用CO2可合成烷烃、烯烃、醇等系列重要化工原料。制备甲烷CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH=-252.9 kJ·mol-1。回答下列有关问题:
(1)该反应的ΔG(ΔG=ΔH-TΔS)与温度的关系如图所示。
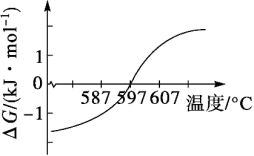
①要使该反应能顺利发生,理论上温度不高于_______ 。
②在恒温、恒容容器中进行该反应,下列不能说明反应达到平衡状态的是_______ (填字母)。
A.CO2和H2的转化率之比不再变化
B.混合气体的平均摩尔质量不再变化
C.容器内的压强不再变化
D.v=4v
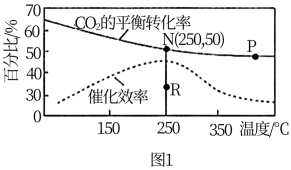
(2)选择合适催化剂,在密闭容器中按n(CO2)∶n(H2)=1∶4充入反应物,反应结果如图所示。
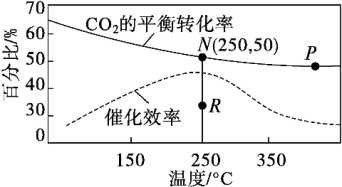
①若N点压强为1 MPa,则平衡常数Kp(N)=_______ ,P点与N点的平衡常数K(P)_______ (填“>”“<”或“=”)K(N)。
②若无催化剂,N点平衡转化率是否可能降至R点?说明理由。答:_______ 。
(1)该反应的ΔG(ΔG=ΔH-TΔS)与温度的关系如图所示。

①要使该反应能顺利发生,理论上温度不高于
②在恒温、恒容容器中进行该反应,下列不能说明反应达到平衡状态的是
A.CO2和H2的转化率之比不再变化
B.混合气体的平均摩尔质量不再变化
C.容器内的压强不再变化
D.v=4v
(2)选择合适催化剂,在密闭容器中按n(CO2)∶n(H2)=1∶4充入反应物,反应结果如图所示。

①若N点压强为1 MPa,则平衡常数Kp(N)=
②若无催化剂,N点平衡转化率是否可能降至R点?说明理由。答:
2022高二·上海·专题练习
类题推荐
利用 可合成烷烃、烯烃、醇、甲酸等系列重要化工原料。回答下列有关问题:
可合成烷烃、烯烃、醇、甲酸等系列重要化工原料。回答下列有关问题:
Ⅰ.制备甲烷 。
。
已知: 的燃烧热为
的燃烧热为 ;
; 的燃烧热为
的燃烧热为 ;
; 。
。
(1)
_______  ,该反应在
,该反应在_______ (填“低温”、“高温”或“任意温度”)下自发。
(2)在恒温、恒容容器中按 充入反应物进行该反应,下列
充入反应物进行该反应,下列不能 说明反应达到平衡状态的是_______。
(3)选择合适催化剂,在体积为VL的恒容容器中按 、
、 充入反应物,反应结果如下图所示。
充入反应物,反应结果如下图所示。
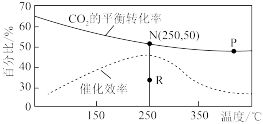
①计算平衡常数K(N)=_______ 。
②若无催化剂,N点平衡转化率是否可能降至R点_______ ,说明理由_______ 。
(4)选择合适催化剂,在相同温度下,分别在恒容容器Ⅰ和恒压容器Ⅱ中充入 和
和 ,起始容器体积相同,反应至平衡,在下图中画出两容器内反应至平衡混合气体平均摩尔质量随时间的变化曲线示意图
,起始容器体积相同,反应至平衡,在下图中画出两容器内反应至平衡混合气体平均摩尔质量随时间的变化曲线示意图_______ 。

Ⅱ.甲醇是重要的化工原料。利用合成气(主要成分为CO、 和
和 )在催化剂的作用下合成甲醇,可能发生的反应如下:
)在催化剂的作用下合成甲醇,可能发生的反应如下:
①
②
③
一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
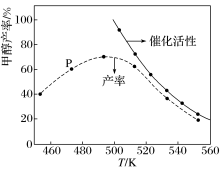
(5)温度为470K时,图中P点_______ (填“处于”或“不处于”)平衡状态,490K之后,甲醇的产率随温度的升高而减小的可能原因除了升高温度使反应①平衡逆向移动以外,还有_______ 。
(6)一定能提高甲醇产率的措施是_______ 。
A.增大压强 B.升高温度 C.加入大量催化剂
Ⅰ.制备甲烷
已知:
(1)
(2)在恒温、恒容容器中按
| A. | B.混合气体的平均摩尔质量不再变化 |
| C.容器内的压强不再变化 | D. |

①计算平衡常数K(N)=
②若无催化剂,N点平衡转化率是否可能降至R点
(4)选择合适催化剂,在相同温度下,分别在恒容容器Ⅰ和恒压容器Ⅱ中充入

Ⅱ.甲醇是重要的化工原料。利用合成气(主要成分为CO、
①
②
③
一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。

(5)温度为470K时,图中P点
(6)一定能提高甲醇产率的措施是
A.增大压强 B.升高温度 C.加入大量催化剂
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网