单选题 适中0.65 引用2 组卷272
合成气是一种重要的化工原料气,主要组分为CO和H2。用甲烷、二氧化碳自热重整可制备合成气,反应原理如下:
反应I:CH4(g)+2O2(g) CO2(g)+2H2O(g) △H1=-820.6kJ·mol-1
CO2(g)+2H2O(g) △H1=-820.6kJ·mol-1
反应II:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H2=+247.1kJ·mol-1
2CO(g)+2H2(g) △H2=+247.1kJ·mol-1
反应III:CH4(g)+H2O(g) CO(g)+3H2(g) △H3=+205.9kJ·mol-1
CO(g)+3H2(g) △H3=+205.9kJ·mol-1
反应IV:CO2(g)+H2(g) CO(g)+H2O(g) △H4
CO(g)+H2O(g) △H4
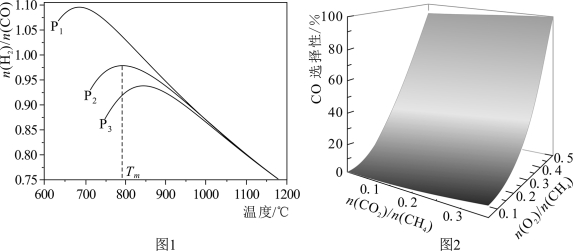
不同温度下,向体积为VL的含少量O2的恒压容器按照n(CO2):n(CH4)=1投料,实验测得不同压强下平衡时 随温度的变化关系如图所示。下列说法正确的是
随温度的变化关系如图所示。下列说法正确的是

反应I:CH4(g)+2O2(g)
反应II:CH4(g)+CO2(g)
反应III:CH4(g)+H2O(g)
反应IV:CO2(g)+H2(g)
不同温度下,向体积为VL的含少量O2的恒压容器按照n(CO2):n(CH4)=1投料,实验测得不同压强下平衡时

| A.△H4=-41.2kJ·mol-1 |
| B.某温度下,反应II的平衡常数随压强增大而减小 |
| C.由图可知,p1>p2>p3 |
| D.压强为p2时,T>Tm后,升高温度对反应IV的促进作用更大 |
22-23高三上·江苏南通·开学考试
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网