解答题-原理综合题 较难0.4 引用1 组卷111
重铬酸钾(K2Cr2O7)是一种强氧化剂,在实验室和工业中都有广泛应用。
(1)实验室可用 和
和 制备重铬酸钾,具体步骤如下:
制备重铬酸钾,具体步骤如下:
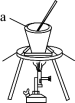
①取过量 粉末放入如图所示装置中,加热至融化。图中仪器
粉末放入如图所示装置中,加热至融化。图中仪器 的名称是
的名称是_______ 。
②称取一定质量的 和
和 固体,研磨后加入到熔融的
固体,研磨后加入到熔融的 中,灼烧35min后得到含铬酸钠(Na2CrO4)的固体及一种常见无色气态化合物。该反应的化学方程式为
中,灼烧35min后得到含铬酸钠(Na2CrO4)的固体及一种常见无色气态化合物。该反应的化学方程式为_______ 。
③取出反应后的固体,加入少量水,加热至沸腾,稍冷后过滤,将所得滤液倒入蒸发皿中,加入 溶液至pH<5。写出用
溶液至pH<5。写出用 试纸测溶液
试纸测溶液 的操作
的操作_______ 。
④再加入适量氯化钾,发生反应 。
。
⑤加热蒸发、冷却结晶、过滤、洗涤、干燥,得到重铬酸钾晶体。
(2)工业上也可用电解铬酸钾的方法制备重铬酸钾( ),电极为钛基复合电极,反应原理如图所示。
),电极为钛基复合电极,反应原理如图所示。
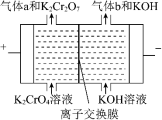
①写出阳极的电极反应式_______ 。
②该电解池中应选择_______ (填“阴”或“阳”)离子交换膜。
(3)已知:固体 灼热时呈棕色,冷却后为绿色,不溶于水,也不溶于酸。铬酸银为砖红色固体,难溶于水。选用下列试剂及用品设计实验方案检验重铬酸钾的热分解产物(4K2Cr2O7
灼热时呈棕色,冷却后为绿色,不溶于水,也不溶于酸。铬酸银为砖红色固体,难溶于水。选用下列试剂及用品设计实验方案检验重铬酸钾的热分解产物(4K2Cr2O7 4K3CrO4+3O2↑+2Cr2O3)
4K3CrO4+3O2↑+2Cr2O3)
试剂及用品:盐酸、 溶液、酒精灯、木条
溶液、酒精灯、木条
(1)实验室可用
①取过量

②称取一定质量的
③取出反应后的固体,加入少量水,加热至沸腾,稍冷后过滤,将所得滤液倒入蒸发皿中,加入
④再加入适量氯化钾,发生反应
⑤加热蒸发、冷却结晶、过滤、洗涤、干燥,得到重铬酸钾晶体。
(2)工业上也可用电解铬酸钾的方法制备重铬酸钾(

①写出阳极的电极反应式
②该电解池中应选择
(3)已知:固体
试剂及用品:盐酸、
| 实验步骤 | 现象 |
| ①取重铬酸钾晶体于硬质玻璃管中,用酒精喷灯加热 | ②固体逐渐变成棕色 |
| ③用排水集气法收集产生的无色气体, | ④ |
| ⑤取冷却后的固体, | ⑥产生砖红色沉淀 |
21-22高二上·安徽滁州·阶段练习
类题推荐
I.钴的配合物制取
实验室以活性炭为催化剂,用CoCl2制取[Co(NH3)6]Cl3,装置如图所示。

(1)仪器a的名称是___________ ;仪器b中的试剂是___________ ;冷凝管作用是___________ 。
II.将0.1 mol/L CoCl2、NH4Cl混合液在三颈烧瓶中混合,滴加浓氨水,溶液变为棕色。已知:①[Co(NH3)6]2+具有较强还原性;溶液呈棕色。②Ksp[Co(OH)2] = 6×10-15
(2)请计算常温下该混合液中Co2+开始沉淀的pH值(精确到0.01),列出必要过程________ 。NH4Cl的作用是___________ 。
(3)充分反应后缓慢滴加双氧水,水浴加热20 min(该过程生成OH-)。发生反应的离子方程式为___________ 。将反应后的混合液冷却后加入适量浓盐酸,过滤、洗涤、干燥,得到[Co(NH3)6]Cl3晶体。
III.已知[Co(NH3)6]Cl3可溶于热水,微溶于冷水,难溶于乙醇。
(4)请运用平衡移动原理解释加入浓盐酸的目的是_____________ 。
(5)[Co(NH3)6]3+ Co3+ + 6NH3 K1;
Co3+ + 6NH3 K1;
 NH3 + H+ K2,判断K1
NH3 + H+ K2,判断K1____ (K2)6。(填“>”“<”或“=”)
(6)洗涤[Co(NH3)6]Cl3时可用___________。
IV.测定产品中配体NH3与外界Cl-的物质的量之比。实验如下:
①蒸氨:取0.100 g样品加入三颈烧瓶中,再加入足量NaOH溶液并充分加热,蒸出的气体全部通入V1 mL c1 mol/L的H2SO4中。
②滴定:用c2 mol/L NaOH溶液滴定①中溶液,消耗V2 mL NaOH溶液。
③沉淀:另取0.100 g样品溶解,加入足量AgNO3溶液,过滤、洗涤、干燥、恒重,得到沉淀m3 g。(MAgCl = 143.5 g/mol)
(7)滴定时选用的指示剂为___________ 。
(8)测得产品中配体NH3与外界Cl-的物质的量比值为________ 。(用含c1、V1等数据的代数式表示)若测得n(NH3) : n(Cl-)比值偏小,可能的原因是________ 。
A.蒸氨结束时,未用蒸馏水洗涤冷凝管,并将洗涤液一并倒入H2SO4中
B.滴定步骤的NaOH溶液使用前敞口放置于空气中一段时间
C.滴定步骤中盛放NaOH溶液的滴定管未用NaOH溶液润洗
D.沉淀步骤中,沉淀未完全转移至漏斗中
实验室以活性炭为催化剂,用CoCl2制取[Co(NH3)6]Cl3,装置如图所示。

(1)仪器a的名称是
II.将0.1 mol/L CoCl2、NH4Cl混合液在三颈烧瓶中混合,滴加浓氨水,溶液变为棕色。已知:①[Co(NH3)6]2+具有较强还原性;溶液呈棕色。②Ksp[Co(OH)2] = 6×10-15
(2)请计算常温下该混合液中Co2+开始沉淀的pH值(精确到0.01),列出必要过程
(3)充分反应后缓慢滴加双氧水,水浴加热20 min(该过程生成OH-)。发生反应的离子方程式为
III.已知[Co(NH3)6]Cl3可溶于热水,微溶于冷水,难溶于乙醇。
(4)请运用平衡移动原理解释加入浓盐酸的目的是
(5)[Co(NH3)6]3+
(6)洗涤[Co(NH3)6]Cl3时可用___________。
| A.蒸馏水 | B.冰水 | C.无水乙醇 | D.50%乙醇水溶液 |
IV.测定产品中配体NH3与外界Cl-的物质的量之比。实验如下:
①蒸氨:取0.100 g样品加入三颈烧瓶中,再加入足量NaOH溶液并充分加热,蒸出的气体全部通入V1 mL c1 mol/L的H2SO4中。
②滴定:用c2 mol/L NaOH溶液滴定①中溶液,消耗V2 mL NaOH溶液。
③沉淀:另取0.100 g样品溶解,加入足量AgNO3溶液,过滤、洗涤、干燥、恒重,得到沉淀m3 g。(MAgCl = 143.5 g/mol)
(7)滴定时选用的指示剂为
(8)测得产品中配体NH3与外界Cl-的物质的量比值为
A.蒸氨结束时,未用蒸馏水洗涤冷凝管,并将洗涤液一并倒入H2SO4中
B.滴定步骤的NaOH溶液使用前敞口放置于空气中一段时间
C.滴定步骤中盛放NaOH溶液的滴定管未用NaOH溶液润洗
D.沉淀步骤中,沉淀未完全转移至漏斗中
重铬酸钾( )是实验室常用的氧化剂。某实验小组以铬铁矿(主要成分为
)是实验室常用的氧化剂。某实验小组以铬铁矿(主要成分为 ,含
,含 、
、 等杂质)为原料制备重铬酸钾,并进行性质验证实验。
等杂质)为原料制备重铬酸钾,并进行性质验证实验。
已知:相关物质在不同温度时的溶解度/g如下表:
实验一:重铬酸钾的制备
步骤Ⅰ:将一定量NaOH和 的固体置于铁坩埚内,加热至熔融,再加铬铁矿粉与
的固体置于铁坩埚内,加热至熔融,再加铬铁矿粉与 继续加热50分钟,发生反应:
继续加热50分钟,发生反应: ,自然冷却。
,自然冷却。
步骤Ⅱ:取出坩埚中的熔块,置于烧杯中,加水并加热煮沸15分钟,冷却后抽滤,弃去含铁固体物质。
步骤Ⅲ:用冰醋酸调节上述滤液pH为7到8,产生浑浊,加热后过滤除去 和
和 ,将滤液转移至蒸发皿中,加冰醋酸调节pH为5。
,将滤液转移至蒸发皿中,加冰醋酸调节pH为5。
步骤Ⅳ:向上述溶液中加KCl,出现少量晶体再次调pH并进行结晶操作,有大量橙色晶体析出,抽滤,用少量冷水洗涤晶体,干燥得 晶体。
晶体。
回答下列问题:
(1)步骤Ⅰ中下列仪器不需要的是_____ (填仪器名称)。

(2)步骤Ⅲ中调节滤液pH用冰醋酸,不用强酸的原因是_______ ,过滤前先加热的目的是________ 。
(3)步骤Ⅳ中的结晶方法是_______ (填“蒸发结晶”或“冷却结晶”),有同学制得的重铬酸钾晶体颜色偏黄,可能的原因是_______ 。
实验二:用重铬酸钾测定 固体试样中铁的含量
固体试样中铁的含量
已知:二苯胺磺酸钠还原态为无色,氧化态为紫红色。
(4)取重铬酸钾晶体配制成0.02mol/L的标准液。称取2.00g 固体试样于锥形瓶中,加15.00mL混合酸,再加水配成100mL溶液,取10.00mL
固体试样于锥形瓶中,加15.00mL混合酸,再加水配成100mL溶液,取10.00mL 溶液于锥形瓶,加入几滴二苯胺磺酸钠作指示剂,用重铬酸钾标准液滴定至由绿色变为紫红色,消耗标准液8.00mL。
溶液于锥形瓶,加入几滴二苯胺磺酸钠作指示剂,用重铬酸钾标准液滴定至由绿色变为紫红色,消耗标准液8.00mL。
①写出滴定时重铬酸钾和硫酸亚铁反应的离子方程式________ 。
②测定 固体试样中铁的质量分数为
固体试样中铁的质量分数为_____ (保留两位小数)。
③测定结果偏大的可能原因是_______ 。
已知:相关物质在不同温度时的溶解度/g如下表:
| 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
| 重铬酸钾 | 4.7 | 12.3 | 26.3 | 45.6 | 73 |
| 重铬酸钠 | 163 | 183 | 215 | 269 | 76 |
步骤Ⅰ:将一定量NaOH和
步骤Ⅱ:取出坩埚中的熔块,置于烧杯中,加水并加热煮沸15分钟,冷却后抽滤,弃去含铁固体物质。
步骤Ⅲ:用冰醋酸调节上述滤液pH为7到8,产生浑浊,加热后过滤除去
步骤Ⅳ:向上述溶液中加KCl,出现少量晶体再次调pH并进行结晶操作,有大量橙色晶体析出,抽滤,用少量冷水洗涤晶体,干燥得
回答下列问题:
(1)步骤Ⅰ中下列仪器不需要的是

(2)步骤Ⅲ中调节滤液pH用冰醋酸,不用强酸的原因是
(3)步骤Ⅳ中的结晶方法是
实验二:用重铬酸钾测定
已知:二苯胺磺酸钠还原态为无色,氧化态为紫红色。
(4)取重铬酸钾晶体配制成0.02mol/L的标准液。称取2.00g
①写出滴定时重铬酸钾和硫酸亚铁反应的离子方程式
②测定
③测定结果偏大的可能原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网