解答题-原理综合题 较难0.4 引用1 组卷408
随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以 和
和 为原料合成尿素:
为原料合成尿素:

(1)下列有利于提高 平衡转化率的措施是___________(填序号)。
平衡转化率的措施是___________(填序号)。
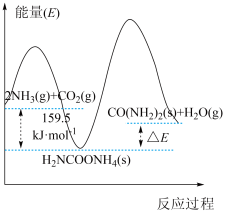
(2)研究发现,合成尿素反应分两步完成,其能量变化如图所示:
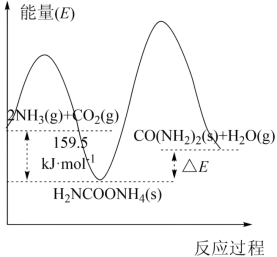
第一步:2NH3(g)+CO2(g)⇌NH2COONH4(s)△H1
第二步:NH2COONH4(g)⇌CO(NH2)2(s)+H2O(g)△H2
①图中
___________  。
。
②反应的决速步是___________ 反应(填“第一步”或“第二步”)。
II.以和催化重整制备合成气: 。
。
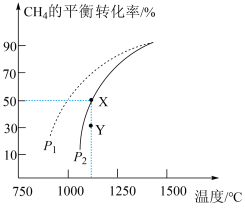
(3)在密闭容器中通入物质的量均为 的
的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应 ,
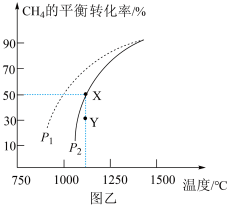
, 的平衡转化率随温度、压强的变化关系如上图所示。
的平衡转化率随温度、压强的变化关系如上图所示。
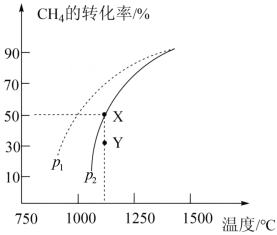
①反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是___________ (填序号)。
A.容器中混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.容器中气体的平均相对分子质量不变
D.同时断裂 键和
键和 键
键
②由图可知,压强
___________  (填“>”、“<”或“=”,);
(填“>”、“<”或“=”,);
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则X点对应温度下的
,则X点对应温度下的
___________ (用含p2的代数式表示)。
III.电化学法还原二氧化碳制乙烯在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示
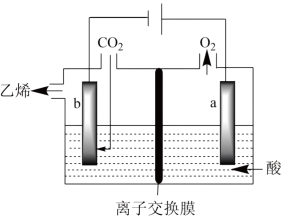
(4)阴极电极反应式为___________ ,该装置中使用的是___________ (填“阴”或“阳”)离子交换膜。
I.以
(1)下列有利于提高
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |

第一步:2NH3(g)+CO2(g)⇌NH2COONH4(s)△H1
第二步:NH2COONH4(g)⇌CO(NH2)2(s)+H2O(g)△H2
①图中
②反应的决速步是
II.以和催化重整制备合成气:
(3)在密闭容器中通入物质的量均为

①反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
A.容器中混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.容器中气体的平均相对分子质量不变
D.同时断裂
②由图可知,压强
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
III.电化学法还原二氧化碳制乙烯在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示

(4)阴极电极反应式为
22-23高三上·重庆沙坪坝·阶段练习
类题推荐
随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
Ⅰ.以 和
和 为原料合成尿素
为原料合成尿素 。
。
(1)有利于提高 平衡转化率的措施是
平衡转化率的措施是_________ (填序号)。
A.高温低压 B.低温高压 C.高温高压
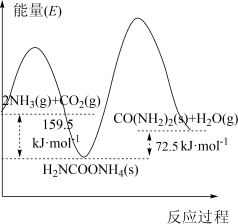
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图甲所示:
第二步:
①图中
_________  。
。
②反应速率较快的是_________ 反应(填“第一步”或“第二步”)。
Ⅱ.以 和
和 催化重整制备合成气:
催化重整制备合成气: 。
。
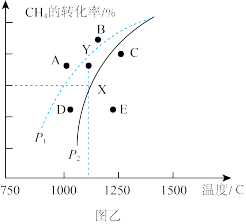
(3)在密闭容器中通入物质的量均为 的
的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应 ,
, 的平衡转化率随温度、压强的变化关系如图乙所示。
的平衡转化率随温度、压强的变化关系如图乙所示。_________ (填序号)。
A.容器中混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.反应速率:
D.同时断裂 键和
键和 键
键
②由图乙可知,压强
_________  (填“>”“<”或“=”,下同);Y点速率
(填“>”“<”或“=”,下同);Y点速率
_________  。
。
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则X点对应温度下的
,则X点对应温度下的
_________ (用含 的代数式表示)。
的代数式表示)。
(4)同温下,某研究小组分别在容积相等的两个恒容密闭容器中加入一定量的反应物,控制反应条件使其仅发生 重整反应,获得如下效据:
重整反应,获得如下效据:
①容器i中反应达到平衡时,生成 的物质的量为
的物质的量为_________ ,容器ii中反应达到平衡状态过程中吸收的热量_________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②容器i的容积变为原来的一半,则 平衡转化率
平衡转化率_________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
Ⅰ.以
(1)有利于提高
A.高温低压 B.低温高压 C.高温高压
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图甲所示:
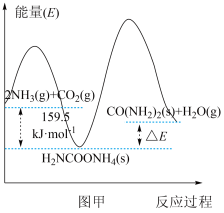
第二步:
①图中
②反应速率较快的是
Ⅱ.以
(3)在密闭容器中通入物质的量均为
A.容器中混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.反应速率:
D.同时断裂
②由图乙可知,压强
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
(4)同温下,某研究小组分别在容积相等的两个恒容密闭容器中加入一定量的反应物,控制反应条件使其仅发生
容器编号 | 起始时各物质的物质的量/mol |
| 达到平衡时体系的压强 | 达到平衡时体系能量的变化 | |||
i | 1 | 2 | 0 | 0 | 吸收热量: | ||
ii | 2 | 4 | 0 | 0 | |||
②容器i的容积变为原来的一半,则
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网