填空题 适中0.65 引用3 组卷256
按要求填空
(1)在25℃,101 kPa下,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为_______ 。
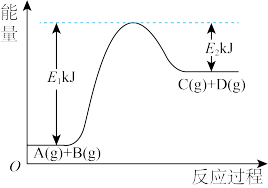
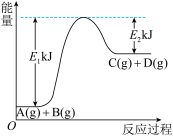
(2)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。
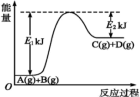
①该反应是_______ (填“吸热”或“放热”)反应,反应的ΔH=_______ kJ· mol-1(用含E1、E2的代数式表示)。
②该反应过程中,断裂旧化学键吸收的总能量_______ (填“>”“ <”或“=”)形成新化学键释放的总能量
(3)由金红石(TiO2)制取单质Ti的步骤为:

已知:Ⅰ.

Ⅱ.

Ⅲ.

① 的
的
_______ 。
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1_______ Q2(填“>”、“<”或“=”)。
(1)在25℃,101 kPa下,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为
(2)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。

①该反应是
②该反应过程中,断裂旧化学键吸收的总能量
(3)由金红石(TiO2)制取单质Ti的步骤为:
已知:Ⅰ.
Ⅱ.
Ⅲ.
①
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1
21-22高二上·西藏拉萨·期中
类题推荐
回答下列问题:
(1)已知常温下红磷比白磷稳定,在下列反应中:
①4P(红磷,s)+5O2(g)=P4O10(s)△H=﹣Q1kJ•mol﹣1
②P4(白磷,s)+5O2(g)=P4O10(s)△H=﹣Q2kJ•mol﹣1
若Q1、Q2均大于零,则Q1和Q2的关系为_______(填字母序号)。
(2)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(中的ΔH表示生成1 mol产物的数据)。

根据上图回答下列问题:
红磷P(s)和Cl2(g)反应生成PCl5(g)的热化学方程式是_______ 。
(3)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是_______ 。
(4)已知反应:N2(g)+O2(g)=2NO(g) △H1
2H2(g)+O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的反应焓变△H4为_______ (用含△H1、△H2、△H3的式子表示)。
(5)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g) +2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s) +O2(g) =CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g) + O2(g) =H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g) =H2O(l) ΔH3=-285.8 kJ·mol-1
则反应2C(s) +2H2(g) +O2(g)=CH3COOH(l)的焓变ΔH为_______
(1)已知常温下红磷比白磷稳定,在下列反应中:
①4P(红磷,s)+5O2(g)=P4O10(s)△H=﹣Q1kJ•mol﹣1
②P4(白磷,s)+5O2(g)=P4O10(s)△H=﹣Q2kJ•mol﹣1
若Q1、Q2均大于零,则Q1和Q2的关系为_______(填字母序号)。
| A.Q1>Q2 | B.Q1=Q2 | C.Q1<Q2 | D.无法确定 |

根据上图回答下列问题:
红磷P(s)和Cl2(g)反应生成PCl5(g)的热化学方程式是
(3)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是
(4)已知反应:N2(g)+O2(g)=2NO(g) △H1
2H2(g)+O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的反应焓变△H4为
(5)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g) +2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s) +O2(g) =CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g) +
则反应2C(s) +2H2(g) +O2(g)=CH3COOH(l)的焓变ΔH为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
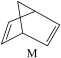
 △H=+88.6kJ•mol-1,则M、N相比,较稳定的是
△H=+88.6kJ•mol-1,则M、N相比,较稳定的是