解答题-原理综合题 适中0.65 引用2 组卷368
在“碳达峰、碳中和”的大背景下,实现 的有效转化成为科研工作者的研究热点,以下是几种常见的
的有效转化成为科研工作者的研究热点,以下是几种常见的 利用方法:
利用方法:
I.以 作催化剂,可使
作催化剂,可使 在温和条件下转化为甲醇,反应经历如下过程:
在温和条件下转化为甲醇,反应经历如下过程:
i.催化剂活化: (无活性)
(无活性) (有活性);
(有活性);
ii. 与
与 在活化的催化剂表面发生反应①:
在活化的催化剂表面发生反应①:
 ,同时也有反应②:
,同时也有反应②:
 等副反应发生。
等副反应发生。
(1)反应①中碳原子的杂化方式变化情况为___________ 。
(2)某温度下,在恒容反应器中,能说明反应①达到平衡状态的是___________(填序号)。
(3)某温度下, 与
与 的混合气体以不同流速通过恒容反应器,气体流速与
的混合气体以不同流速通过恒容反应器,气体流速与 转化率、
转化率、 选择性的关系如图,(已知:
选择性的关系如图,(已知: 选择性
选择性 )
) 选择性随气体流速增大而升高的原因可能有:
选择性随气体流速增大而升高的原因可能有:
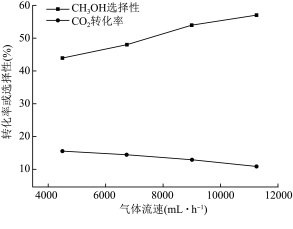
①___________ 。
②气体流速增大可减少产物中 的积累,减少催化剂的失活,从而提高
的积累,减少催化剂的失活,从而提高 选择性,请用化学方程式表示催化剂失活的原因:
选择性,请用化学方程式表示催化剂失活的原因:___________ 。
(4)碳酸氢盐分解可获得 ,在T℃时,将足量的某碳酸氢盐
,在T℃时,将足量的某碳酸氢盐 固体置于真空恒容容器中,存在如下平衡:
固体置于真空恒容容器中,存在如下平衡: 。上述反应达平衡时体系的总压为
。上述反应达平衡时体系的总压为 。保持温度不变,开始时在体系中先通入一定量的
。保持温度不变,开始时在体系中先通入一定量的 ,再加入足量
,再加入足量 ,欲使平衡时体系中水蒸气的分压小于
,欲使平衡时体系中水蒸气的分压小于 ,则开始时通入
,则开始时通入 的初始压强应大于
的初始压强应大于___________ 。
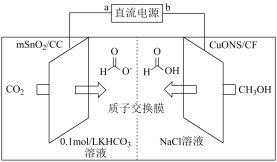
II.一种以甲醇和二氧化碳为原料,利用活性催化电极,电化学法制备甲酸(甲酸盐),其工作原理如图所示。
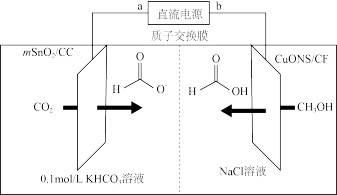
(5)①b极为直流电源的___________ 极,写出电解过程中阴极表面发生的电极反应式:___________ 。
②若有1mol 通过质子交换膜时,该装置内生成
通过质子交换膜时,该装置内生成 和HCOOH共计
和HCOOH共计___________ mol。
I.以
i.催化剂活化:
ii.
(1)反应①中碳原子的杂化方式变化情况为
(2)某温度下,在恒容反应器中,能说明反应①达到平衡状态的是___________(填序号)。
| A. |
| B.混合气体的平均摩尔质量不变 |
| C.混合气体的密度不变 |
| D. |

①
②气体流速增大可减少产物中
(4)碳酸氢盐分解可获得
II.一种以甲醇和二氧化碳为原料,利用活性催化电极,电化学法制备甲酸(甲酸盐),其工作原理如图所示。

(5)①b极为直流电源的
②若有1mol
22-23高三上·重庆渝中·阶段练习
类题推荐
在“碳达峰、碳中和”的目标引领下,减少 排放实现
排放实现 的有效转化成为科研工作者的研究热点。根据以下几种常见的
的有效转化成为科研工作者的研究热点。根据以下几种常见的 利用方法,回答下列问题。
利用方法,回答下列问题。
I.以 作催化剂,采用“
作催化剂,采用“ 催化加氢制甲醇”方法将其资源化利用。反应历程如下:
催化加氢制甲醇”方法将其资源化利用。反应历程如下:
i.催化剂活化: (无活性)
(无活性) (有活性);
(有活性);
ii. 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:
①主反应:
 ,
,
②副反应:
 。
。
(1)某温度下,在恒容反应器中,能说明反应①达到平衡状态的是_______(填序号)。
(2)a. 选择性随气体流速增大而升高的原因可能是
选择性随气体流速增大而升高的原因可能是_______ 。(已知: 选择性
选择性 )
)
b.某温度下, 与
与 的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中
的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中 的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:
的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:_______ 。
(3)反应①、②的 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。

升高温度,反应 的化学平衡常数
的化学平衡常数_______ (填“增大”或“减小”或“不变”)。
(4)恒温恒压密闭容器中,加入2mol 和4mol
和4mol ,只发生反应①和反应②,初始压强为
,只发生反应①和反应②,初始压强为 。
。
a.在230℃以上,升高温度 的平衡转化率增大,但甲醇的产率降低,原因是
的平衡转化率增大,但甲醇的产率降低,原因是_______ 。
b.在300℃发生反应,反应达平衡时, 的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=
的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=_______ (保留两位有效数字)。
II.利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
i.
ii.
上述反应中 为吸附活性炭,反应历程的能量变化如图1所示:
为吸附活性炭,反应历程的能量变化如图1所示:

(5) 干重整反应的速率由决定
干重整反应的速率由决定_______ (填“反应i”或“反应ⅱ”), 干重整反应的热化方程式为
干重整反应的热化方程式为_______ 。(选取图1中 、
、 、
、 表示反应热)。
表示反应热)。
I.以
i.催化剂活化:
ii.
①主反应:
②副反应:
(1)某温度下,在恒容反应器中,能说明反应①达到平衡状态的是_______(填序号)。
| A.分别用 |
| B.混合气体的平均摩尔质量不变 |
| C.混合气体的密度不变 |
| D. |
b.某温度下,
(3)反应①、②的

升高温度,反应
(4)恒温恒压密闭容器中,加入2mol
a.在230℃以上,升高温度
b.在300℃发生反应,反应达平衡时,
II.利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
i.
ii.
上述反应中

(5)
减少CO2排放并实现CO2的有效转化已成为科研工作者的研究热点。根据以下两种常见的CO2利用方法,回答下列问题:
(I)在钌配合物催化作用下采用“CO2催化加氢制甲酸”方法将CO2资源化利用。
反应为:CO2(g)+H2(g) HCOOH(g) ΔH
HCOOH(g) ΔH
(1)已知:298K时,部分物质的相对能量如表所示,ΔH =_______ kJ·mol-1,该反应在_____ (填“高温”、“低温”或者“任意温度” )易自发进行。
(II)以氧化铟(In2O3)作催化剂,采用“CO2催化加氢制甲醇”方法将CO2资源化利用。反应历程如下:
i.催化剂活化:In2O3 (无活性) In2O3-x (有活性)
In2O3-x (有活性)
ii.CO2与H2在活化的催化剂表面同时发生如下反应:
反应①:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应②:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
(2)某温度下,在恒容密闭反应器发生以上反应,下列能说明反应①达到平衡状态的是___ (填标号)。
(3)增大CO2和H2混合气体的流速,可减少产物中H2O(g)的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:__________ 。
(4)ii中反应①、②的lnK(K代表化学平衡常数)随 ×103 (T代表温度)的变化如图所示
×103 (T代表温度)的变化如图所示

请在上述图中画出反应CO(g)+2H2(g) CH3OH(g)的 lnK 随
CH3OH(g)的 lnK 随 ×103变化的曲线
×103变化的曲线_______ 。
(5)在恒温密闭容器中,维持压强和投料比不变,将CO2和H2按一定流速通过反应器, CO2的转化率[α(CO2)%]和甲醇的选择性[x(CH3OH)%= ×100%]随着温度变化关系如图所示。
×100%]随着温度变化关系如图所示。
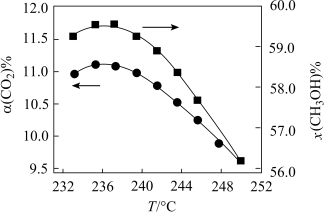
若233~251°C时催化剂的活性受温度影响不大,分析温度高于235°C时图中曲线下降的原因________ 。
(6)恒温恒压密闭容器中,加入2molCO2和4molH2,同时发生反应①和反应②,初始压强为p0,在300°C发生反应,反应达到平衡时,CO2的转化率为50%,容器体积减小20%,则反应②用平衡分压表示的平衡常数Kp=________ (保留两位有效数字)。
(I)在钌配合物催化作用下采用“CO2催化加氢制甲酸”方法将CO2资源化利用。
反应为:CO2(g)+H2(g)
(1)已知:298K时,部分物质的相对能量如表所示,ΔH =
物质 | CO2(g) | H2(g) | H2O(g) | CO(g) | HCOOH(g) |
相对能量/kJ ·mol-1) | -393 | 0 | -242 | -110 | -423.9 |
(II)以氧化铟(In2O3)作催化剂,采用“CO2催化加氢制甲醇”方法将CO2资源化利用。反应历程如下:
i.催化剂活化:In2O3 (无活性)
ii.CO2与H2在活化的催化剂表面同时发生如下反应:
反应①:CO2(g)+3H2(g)
反应②:CO2(g)+H2(g)
(2)某温度下,在恒容密闭反应器发生以上反应,下列能说明反应①达到平衡状态的是___ (填标号)。
| A.v正(H2):v逆(CH3OH)=3:1 |
| B.混合气体的平均摩尔质量保持不变 |
| C.混合气体的密度保持不变 |
| D.CH3OH(g)的分压保持不变 |
(4)ii中反应①、②的lnK(K代表化学平衡常数)随

请在上述图中画出反应CO(g)+2H2(g)
(5)在恒温密闭容器中,维持压强和投料比不变,将CO2和H2按一定流速通过反应器, CO2的转化率[α(CO2)%]和甲醇的选择性[x(CH3OH)%=

若233~251°C时催化剂的活性受温度影响不大,分析温度高于235°C时图中曲线下降的原因
(6)恒温恒压密闭容器中,加入2molCO2和4molH2,同时发生反应①和反应②,初始压强为p0,在300°C发生反应,反应达到平衡时,CO2的转化率为50%,容器体积减小20%,则反应②用平衡分压表示的平衡常数Kp=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网