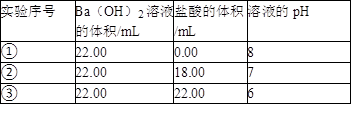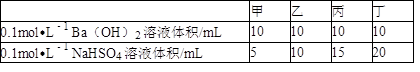解答题-原理综合题 困难0.15 引用1 组卷342
已知水在25℃和95℃时,其电离平衡曲线如图所示:
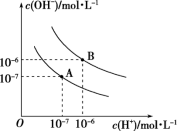
(1)则25℃时水的电离平衡曲线应为_______ (填“A”或“B”),请说明理由:_______ 。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为_______ 。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_______ 。
(4)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
假设溶液混合前后的体积不变,则a=_______ ,实验②所得溶液中由水电离产生的c(OH-)=_______ mol·L-1。
(5)95℃时,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显_______ (填“酸”“碱”或“中”)性。
②写出按乙方式混合后,反应的化学方程式:_______ ,所得溶液显_______ (填“酸”“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为_______ (混合时,忽略溶液体积的变化)。
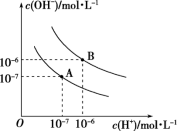
(1)则25℃时水的电离平衡曲线应为
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
(4)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积不变,则a=
(5)95℃时,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 | |
| 0.1mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显
②写出按乙方式混合后,反应的化学方程式:
③按甲方式混合,所得溶液的pH为
21-22高二上·河南三门峡·阶段练习
类题推荐
某温度(T ℃)下的溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:

(1)此温度下,水的离子积Kw为________ ,则该温度T______ 25(填“>”、“<”或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
假设溶液混合前后的体积变化忽略不计,则a=________ ,实验②中由水电离产生的c(OH-)=______ mol·L-1。
(3)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显________ (填“酸”、“碱”或“中”)性。
②写出按乙方式混合后,反应的离子方程式:________________________ 。
③按甲方式混合后,所得溶液的pH为__________ 。

(1)此温度下,水的离子积Kw为
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a=
(3)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 | |
| 0.1 mol·L-1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1 mol·L-1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显
②写出按乙方式混合后,反应的离子方程式:
③按甲方式混合后,所得溶液的pH为
某温度(T℃)下的溶液中,[H+]=10-xmol·L-1,[OH-]=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:
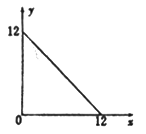
(1)此温度下,水的离子积KW=______________ ,则该温度T________ 25℃(填“>” “<”或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH 如下表所示:
假设溶液混合前后的体积变化忽略不计,则a=________ , 实验②中由水电离产生的[OH-]=______ mol·L-1。
(3)在此温度下,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显__________ 性(填“酸”“碱”或“中”)。
②写出按乙方式混合后,反应的离子方程式:____________________ 。
③按甲方式混合后,所得溶液的pH 为_____________ 。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a________ (填“>” “<”或“=”)0.01;用含a的代数式表示HCN 的电离常数Ka=___________ 。

(1)此温度下,水的离子积KW=
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH 如下表所示:
| 实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
(3)在此温度下,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 | |
| 0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1 mol • L-l NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
②写出按乙方式混合后,反应的离子方程式:
③按甲方式混合后,所得溶液的pH 为
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网