解答题-原理综合题 适中0.65 引用2 组卷171
乙烯是一种重要的有机化工原料。利用二氧化碳氧化乙烷制备乙烯的原理如下:
I.

II.

(1)①总反应 的
的 为
为_______  。
。
②一定温度下,向初始压强为2p的刚性容器中充入等物质的量的乙烷和二氧化碳,发生上述总反应,乙烷的平衡转化率为a,则反应的压强平衡常数
_______ 。
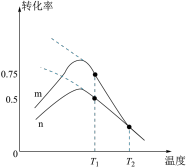
(2)K为总反应的平衡常数, 与温度的倒数
与温度的倒数 的变化如下图所示:
的变化如下图所示:
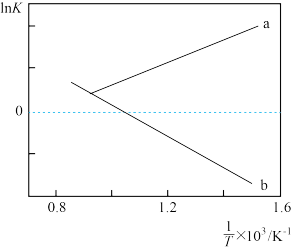
以上曲线中表示总反应的曲线的是_______ (填标号),理由是_______ 。
(3)在高温条件下,乙烷脱氢会发生副反应: ;
; 。
。
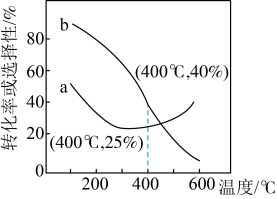
在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 的平衡转化率和
的平衡转化率和 的平衡选择性随温度的变化如下表所示:(
的平衡选择性随温度的变化如下表所示:( 的选择性
的选择性 )
)
①乙烯的平衡选择性随温度升高而降低的原因是_______ 。
②研究发现,向反应体系中增加 ,产物中C(s)会减少,请用方程式说明原因
,产物中C(s)会减少,请用方程式说明原因_______ 。
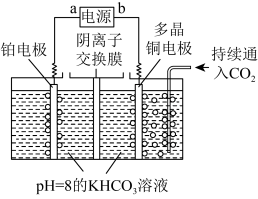
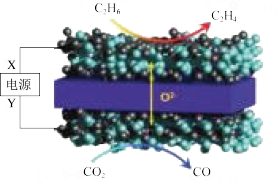
(4)科学家利用固体氧化物电解池也能实现 和
和 的耦合转化,原理如下图所示。则Y是电源的
的耦合转化,原理如下图所示。则Y是电源的_______ (填“正极”或“负极”);正极区的电极反应式为_______ 。
I.
II.
(1)①总反应
②一定温度下,向初始压强为2p的刚性容器中充入等物质的量的乙烷和二氧化碳,发生上述总反应,乙烷的平衡转化率为a,则反应的压强平衡常数
(2)K为总反应的平衡常数,

以上曲线中表示总反应的曲线的是
(3)在高温条件下,乙烷脱氢会发生副反应:
在恒压、
| 温度/℃ | ||
| 625 | 10.5 | 96.5 |
| 650 | 17.8 | 96.0 |
| 675 | 25.2 | 95.1 |
| 700 | 35 | 92.6 |
②研究发现,向反应体系中增加
(4)科学家利用固体氧化物电解池也能实现

22-23高三上·湖北武汉·开学考试
类题推荐
苯乙烯是一种重要的有机化工原料,可利用乙苯催化脱氢法制备。实际生产中常在体系中充入一定量的 ,主要反应如下:
,主要反应如下:
Ⅰ.简单脱氢反应:

 ;
;
Ⅱ.逆水煤气反应:
 ;
;
Ⅲ.氧化脱氢反应:



请回答:
(1)反应Ⅱ能自发进行,则
_______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”),有利于反应Ⅲ自发进行的条件是
”),有利于反应Ⅲ自发进行的条件是_______ 。
(2)关于上述反应,下列说法正确的是_______。
(3)碳酸钙受热发生分解反应 ,600℃时该反应的平衡常数
,600℃时该反应的平衡常数 ,向
,向 密闭容器中加入过量碳酸钙,充入
密闭容器中加入过量碳酸钙,充入 乙苯气体,在600℃下发生反应Ⅲ,平衡时乙苯的转化率为40%,该温度下反应Ⅲ的平衡常数
乙苯气体,在600℃下发生反应Ⅲ,平衡时乙苯的转化率为40%,该温度下反应Ⅲ的平衡常数
_______ (用字母a、b表示)。
(4)由于发生副反应,常伴随 、
、 、
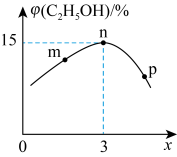
、 等副产物生成。在不同反应温度下,乙苯的转化率和某催化剂作用下苯乙烯的选择性(可定量描述产物中苯乙烯含量的高低)示意图如图1:
等副产物生成。在不同反应温度下,乙苯的转化率和某催化剂作用下苯乙烯的选择性(可定量描述产物中苯乙烯含量的高低)示意图如图1:

图1
控制反应的温度约为600∼700℃,理由是_______ 。
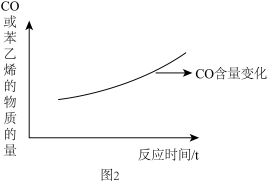
(5)经研究,工业生产中反应Ⅰ和反应Ⅲ在某催化剂条件下是同时发生的,产物主要是 和苯乙烯。在初始阶段,以反应Ⅲ为主,随着时间的延长,反应Ⅰ逐渐占主导地位。请在图2的基础上画出产物苯乙烯的物质的量随反应时间的变化曲线
和苯乙烯。在初始阶段,以反应Ⅲ为主,随着时间的延长,反应Ⅰ逐渐占主导地位。请在图2的基础上画出产物苯乙烯的物质的量随反应时间的变化曲线_______ 。
Ⅰ.简单脱氢反应:

Ⅱ.逆水煤气反应:
Ⅲ.氧化脱氢反应:


请回答:
(1)反应Ⅱ能自发进行,则
(2)关于上述反应,下列说法正确的是_______。
| A.在恒温体积不变的密闭容器中,混合气体的密度不变时,不能说明反应体系已达到平衡 |
| B.升高温度,降低压强,加入催化剂均可提高乙苯的平衡转化率 |
| C.对于反应Ⅲ,恒温恒压下达到平衡时,通入 |
| D.在乙苯脱氢反应体系中,将 |
(4)由于发生副反应,常伴随

图1
控制反应的温度约为600∼700℃,理由是
(5)经研究,工业生产中反应Ⅰ和反应Ⅲ在某催化剂条件下是同时发生的,产物主要是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网