解答题-原理综合题 适中0.65 引用1 组卷73
碳基能源的大量消耗使大气中CO2的浓度持续不断地增大,造成的温室效应得到了世界各国的广泛重视。CO2甲烷化是有效利用二氧化碳资源的途径之一,是减少CO2的一种比较有效的实际方法,在环境保护方面显示出较大潜力。CO2甲烷化过程涉及的化学反应如下:
①CO2甲烷化反应:CO2(g) +4H2(g) CH4(g) +2H2O(g)
CH4(g) +2H2O(g)  H=-165 kJ·mol-1
H=-165 kJ·mol-1
②逆水煤气变换反应:CO2(g) + H2(g) CO(g) + H2O(g)
CO(g) + H2O(g)  H=+41.1 kJ·mol-1
H=+41.1 kJ·mol-1
(1)写出CO甲烷化反应的热化学方程式:_______ 。
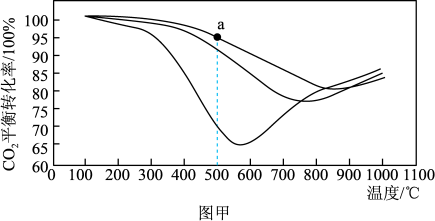
(2)图甲是温度和压强对CO2平衡转化率影响的关系图。该实验条件下的压强有0.1MPa、3.0MPa、10.0MPa,图中a点压强为_______ MPa。
(3)图乙是反应条件对CO2甲烷化反应中CH4选择性影响的关系图。工业上一般选用的温度为400℃,则压强应选用_______ MPa。

(4)450°C时,若在体积为1 L的恒容密闭容器中加入1 mol CO2和4 mol H2混合原料气只发生反应:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH=-165 kJ·mol-1。平衡时CO2的转化率为75%,则该温度下此反应的平衡常数K=
CH4(g)+2H2O(g) ΔH=-165 kJ·mol-1。平衡时CO2的转化率为75%,则该温度下此反应的平衡常数K=_______ 。
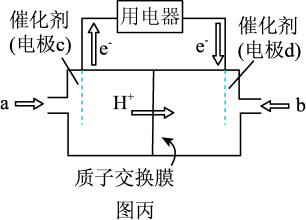
(5)废气中的CO2可转化为甲醚(CH3OCH3),甲醚可用于制作甲醚燃料电池(如图丙),质子交换膜左右两侧溶液均为6 mol·L-1的H2SO4溶液。则电极d为_______ (填“正”或“负”)极,电极c上发生的电极反应为_______ 。
①CO2甲烷化反应:CO2(g) +4H2(g)
②逆水煤气变换反应:CO2(g) + H2(g)
(1)写出CO甲烷化反应的热化学方程式:
(2)图甲是温度和压强对CO2平衡转化率影响的关系图。该实验条件下的压强有0.1MPa、3.0MPa、10.0MPa,图中a点压强为

(3)图乙是反应条件对CO2甲烷化反应中CH4选择性影响的关系图。工业上一般选用的温度为400℃,则压强应选用

(4)450°C时,若在体积为1 L的恒容密闭容器中加入1 mol CO2和4 mol H2混合原料气只发生反应:CO2(g)+4H2(g)
(5)废气中的CO2可转化为甲醚(CH3OCH3),甲醚可用于制作甲醚燃料电池(如图丙),质子交换膜左右两侧溶液均为6 mol·L-1的H2SO4溶液。则电极d为

21-22高二下·云南昆明·期中
类题推荐
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g ) △H=—129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为__________________ 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如右图。
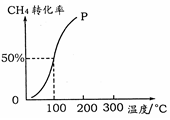
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为_____________ 。
②100℃时反应I的平衡常数为__________ 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是_________ (填字母序号)。
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:
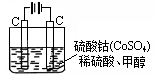
① 写出阳极电极反应式_____________________ 。
② 写出除去甲醇的离子方程式_______________ 。
③若右图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式________________ ,净化含1mol甲醇的水燃料电池需消耗KOH___________ mol。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g ) △H=—129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如右图。

①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为
②100℃时反应I的平衡常数为
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是
| A.c ( H2 )减少 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 |
| D.重新平衡c ( H2 )/ c (CH3OH )减小 |
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:

① 写出阳极电极反应式
② 写出除去甲醇的离子方程式
③若右图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式
甲醇是重要的有机化工原料,目前世界甲醇年产量超过2.1×107吨,在能源紧张的今天,甲醇的需求也在增大。
甲醇的合成方法是:(ⅰ)CO(g)+2H2(g)⇌CH3OH(g) ΔH=-90.1 kJ· mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ· mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0 kJ· mol-1
若混合气体中有二氧化碳存在时,还发生下列反应:
(ⅳ)CO2(g)+H2(g) ⇌CO(g)+H2O(g) ΔH=+41.1 kJ· mol-1
(1)甲醇的燃烧热为______ kJ· mol-1。
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为_ 。
(3)若反应在密闭恒容绝热容器中进行,反应(ⅳ)对合成甲醇反应中CO的转化率的影响是___ 。
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如表:
①x=_______ 。
②前2 min内H2的平均反应速率为v(H2)=__ 。该温度下,反应(ⅰ)的平衡常数K=____ 。
③反应进行到第2 min时,改变了反应条件,改变的这个条件可能是___ (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)图是温度、压强与反应(ⅰ)中CO转化率的关系:
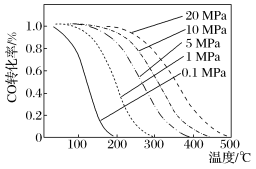
①由图象可知,较低温度时,CO转化率对________ (选填“温度”或“压强”)敏感。
②由图象可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400 ℃和10 MPa的条件,其原因是___________ 。
(6)在一容积为2 L的密闭容器内加入2 mol的CO和6 mol 的H2,在一定条件下发生反应(ⅰ)。该反应的逆反应速率与时间的关系如图所示:
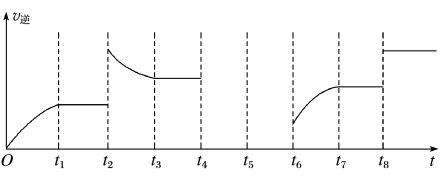
①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是________________ 。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在上图中画出t4~t6时逆反应速率与时间的关系曲线________ 。
甲醇的合成方法是:(ⅰ)CO(g)+2H2(g)⇌CH3OH(g) ΔH=-90.1 kJ· mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ· mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0 kJ· mol-1
若混合气体中有二氧化碳存在时,还发生下列反应:
(ⅳ)CO2(g)+H2(g) ⇌CO(g)+H2O(g) ΔH=+41.1 kJ· mol-1
(1)甲醇的燃烧热为
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为
(3)若反应在密闭恒容绝热容器中进行,反应(ⅳ)对合成甲醇反应中CO的转化率的影响是
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如表:
| 浓度/mol·L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
①x=
②前2 min内H2的平均反应速率为v(H2)=
③反应进行到第2 min时,改变了反应条件,改变的这个条件可能是
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)图是温度、压强与反应(ⅰ)中CO转化率的关系:

①由图象可知,较低温度时,CO转化率对
②由图象可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400 ℃和10 MPa的条件,其原因是
(6)在一容积为2 L的密闭容器内加入2 mol的CO和6 mol 的H2,在一定条件下发生反应(ⅰ)。该反应的逆反应速率与时间的关系如图所示:

①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在上图中画出t4~t6时逆反应速率与时间的关系曲线
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网