解答题-实验探究题 适中0.65 引用2 组卷469
某实验小组通过铁与盐酸反应的实验,研究影响反应速率的因素(铁的质量相等,铁块的形状一样,盐酸均过量),设计实验如下表:
(1)若四组实验均反应1分钟(铁有剩余),则以上实验需要测出的数据是___________ 。
(2)实验___________ 和___________ (填实验编号)是研究盐酸的浓度对该反应速率的影响;实验1和2是研究___________ 对该反应速率的影响。
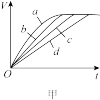
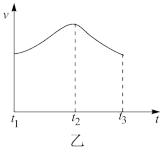
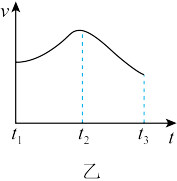
(3)测定在不同时间产生氢气体积V的数据,绘制出图甲,则曲线c、d分别对应的实验组别可能是___________ 、___________ 。
(4)分析其中一组实验,发现产生氢气的速率随时间变化情况如图乙所示。
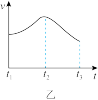
①其中t1~t2速率变化的主要原因是___________ 。
②t2~t3速率变化的主要原因是___________ 。
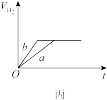
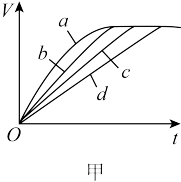
(5)实验1产生氢气的体积如图丙中的曲线a,添加某试剂能使曲线a变为曲线b的是___________(填序号)。
(6)在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
已知:2 min内v(Q)=0.075 mol/(L·min),v(Z):v(Y)=1:2。
请回答下列问题:
①2 min内Z的反应速率v(Z)=___________ 。
②起始时n(Y)=___________ 、n(Q)=___________ 。
③化学方程式中m=___________ 、n=___________ 、p=___________ 、q=___________ 。
④对于该反应,能增大正反应速率的措施是___________ (填序号)。
A.增大容器容积 B.移走部分Q C.通入大量X D.升高温度
| 实验编号 | 盐酸浓度/(mol/L) | 铁的形态 | 温度/K |
| 1 | 4.00 | 块状 | 293 |
| 2 | 4.00 | 粉末 | 293 |
| 3 | 2.00 | 块状 | 293 |
| 4 | 2.00 | 粉末 | 313 |
(2)实验
(3)测定在不同时间产生氢气体积V的数据,绘制出图甲,则曲线c、d分别对应的实验组别可能是

(4)分析其中一组实验,发现产生氢气的速率随时间变化情况如图乙所示。

①其中t1~t2速率变化的主要原因是
②t2~t3速率变化的主要原因是
(5)实验1产生氢气的体积如图丙中的曲线a,添加某试剂能使曲线a变为曲线b的是___________(填序号)。

| A.CuO粉末 | B.NaNO3固体 | C.NaCl溶液 | D.浓H2SO4 |
| 物质 | X | Y | Z | Q |
| n(起始)/mol | 0.7 | 1.0 | ||
| n(2 min末)/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| n(3 min末)/mol | 0.8 |
请回答下列问题:
①2 min内Z的反应速率v(Z)=
②起始时n(Y)=
③化学方程式中m=
④对于该反应,能增大正反应速率的措施是
A.增大容器容积 B.移走部分Q C.通入大量X D.升高温度
2021高二上·江苏无锡·专题练习
类题推荐
某同学利用铁与硫酸的反应,探究影响反应速率的因素(实验所用铁的质量相等且铁块的形状相同,硫酸均过量),实验设计如表:
回答下列问题:
(1)若四组实验均以收集到448mL(标准状况)氢气为标准,则上述实验中还需要测定的数据是_______ 。
(2)实验1和2是探究_______ 对该反应速率的影响;实验_______ 和_______ 是探究温度对该反应速率的影响。
(3)根据实验测得的在不同时间t产生氢气体积V的数据,绘制得到图甲,则曲线c对应的实验组别可能是_______ 。根据实验数据,该同学发现对于每一组实验,产生氢气的速率v随时间t变化情况如图乙所示,其中t1~t2速率变化的主要原因是_______ 。
(4)若上述实验所用硫酸体积均为250mL,实验3反应进行2min时收集到448mL(标准状况)氢气,该时间段内以硫酸的浓度变化表示的平均反应速率v(H2SO4)=_______ (反应后溶液体积不变)。
(5)实验4如果反应太激烈,为了减缓反应速率而又不影响产生氢气的量,下列措施你认为可行的是_______ (填编号)。
(6)进行实验3时,若将稀硫酸改为40mL4.0mol·L-1盐酸(其他条件不变),发现放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是_______ (忽略温度对反应速率的影响)。
| 实验编号 | 硫酸浓度/(mol·L-1) | 硫酸体积/mL | 铁的状态 | 温度/K |
| 1 | 1.00 | 40 | 块状 | 293 |
| 2 | 2.00 | 40 | 块状 | 293 |
| 3 | 2.00 | 40 | 粉末 | 293 |
| 4 | 2.00 | 40 | 块状 | 313 |
(1)若四组实验均以收集到448mL(标准状况)氢气为标准,则上述实验中还需要测定的数据是
(2)实验1和2是探究
(3)根据实验测得的在不同时间t产生氢气体积V的数据,绘制得到图甲,则曲线c对应的实验组别可能是


(4)若上述实验所用硫酸体积均为250mL,实验3反应进行2min时收集到448mL(标准状况)氢气,该时间段内以硫酸的浓度变化表示的平均反应速率v(H2SO4)=
(5)实验4如果反应太激烈,为了减缓反应速率而又不影响产生氢气的量,下列措施你认为可行的是
| A.加蒸馏水 | B.减小压强 | C.加入CH3COONa | D.加CuSO4固体 |
某同学利用铁与盐酸的反应,探究影响反应速率的因素(实验所用铁的质量相等且铁块的形状相同,盐酸均过量),实验设计如表:
回答下列问题:
(1)若四组实验均以收集到448 mL(标准状况)氢气为标准,则上述实验中还需要测定的数据是________ 。
(2)实验1和2是探究________ 对该反应速率的影响;实验________ 和________ 是探究温度对该反应速率的影响。
(3)根据实验测得的在不同时间t产生氢气体积V的数据,绘制得到图甲,则曲线c对应的实验组别可能是________ 。根据实验数据,该同学发现对于每一组实验,产生氢气的速率υ随时间t变化情况如图乙所示,其中t1~t2速率变化的主要原因是________ 。________ 。
| 实验编号 | 盐酸浓度/(mol·L-1) | 铁的状态 | 温度/K |
| 1 | 2.00 | 块状 | 293 |
| 2 | 4.00 | 块状 | 293 |
| 3 | 4.00 | 粉末 | 293 |
| 4 | 4.00 | 块状 | 313 |
(1)若四组实验均以收集到448 mL(标准状况)氢气为标准,则上述实验中还需要测定的数据是
(2)实验1和2是探究
(3)根据实验测得的在不同时间t产生氢气体积V的数据,绘制得到图甲,则曲线c对应的实验组别可能是
某同学利用铁与硫酸的反应,探究影响反应速率的因素(实验所用铁的质量相等且铁块的形状相同,硫酸均过量),实验设计如表,回答下列问题:
(1)若四组实验均以收集到448mL(折算为标准状况下)氢气为标准,则上述实验中还需要测定的数据是_______ 。
(2)实验1和2是探究_______ 对该反应速率的影响;实验_______ 和_______ 是探究温度对该反应速率的影响。
(3)根据实验测得的在不同时间t产生氢气体积V的数据,绘制得到图甲,则曲线c对应的实验组别是_______ 。根据实验数据,该同学发现对于每一组实验,产生氢气的速率v随时间t变化情况如图乙所示,其中t1~t2速率变化的主要原因是_______ 。
(5)进行实验3时,若将稀硫酸改为40 mL 4.0 mol/L盐酸(其他条件不变),发现盐酸中放出气泡的速率明显比硫酸快。你认为可能的原因是_______ (忽略温度对反应速率的影响)。
(6)铁与硫酸的反应制取氢气的实验中,发现加入少量CuSO4溶液时,生成氢气的速率会大大提高,请分析主要原因:_______ 。
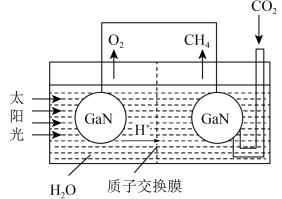
(7)下图表示铜与氮化镓组装成的人工光合系统的工作原理,铜电极上发生反应的电极反应式为____ 。向该系统中通入标况下6.72LCO2,理论上可产生氧气的物质的量为____ mol。
| 实验编号 | 铁的状态 | 温度/.K | ||
| 1 | 1.00 | 40 | 块状 | 293 |
| 2 | 2.00 | 40 | 块状 | 293 |
| 3 | 2.00 | 40 | 粉末 | 293 |
| 4 | 2.00 | 40 | 块状 | 313 |
(1)若四组实验均以收集到448mL(折算为标准状况下)氢气为标准,则上述实验中还需要测定的数据是
(2)实验1和2是探究
(3)根据实验测得的在不同时间t产生氢气体积V的数据,绘制得到图甲,则曲线c对应的实验组别是

| A.加蒸馏水 | B.减小压强 | C.加入CH3COONa | D.加CuSO4固体 |
(5)进行实验3时,若将稀硫酸改为40 mL 4.0 mol/L盐酸(其他条件不变),发现盐酸中放出气泡的速率明显比硫酸快。你认为可能的原因是
(6)铁与硫酸的反应制取氢气的实验中,发现加入少量CuSO4溶液时,生成氢气的速率会大大提高,请分析主要原因:
(7)下图表示铜与氮化镓组装成的人工光合系统的工作原理,铜电极上发生反应的电极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


