解答题-原理综合题 适中0.65 引用3 组卷456
NO2和N2O4是氮的两种重要氧化物。回答下列问题:
Ⅰ.已知下列反应在298K时的反应焓变:
①N2(g)+O2(g)=2NO(g) △H1=180.5 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-112 kJ·mol-1
③N2(g)+2O2(g)=N2O4(g) △H3=10.7 kJ·mol-1
(1)写出N2O4(g)转化为NO2(g)的热化学方程式:_______ 。
Ⅱ.298K时,在2 L的恒容绝热密闭容器中发生反应:N2O4(g) 2NO2(g)反应过程中各气体浓度随时间变化的情况如图所示。
2NO2(g)反应过程中各气体浓度随时间变化的情况如图所示。
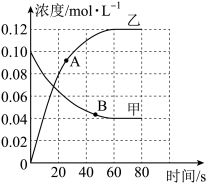
(2)代表NO2气体浓度随时间变化的曲线为_______ (填“甲”或“乙”)。
(3)当N2O4的浓度为0.08 mol·L-1时,反应时间为t s,则0~t s时,用NO2气体的浓度变化量表达该反应的平均速率为_______ 。
(4)A、B两点对应时刻,反应速率大小:vA_______ vB(填“>”“<”或“=”)。
(5)不能说明该反应达到平衡状态的是_______ (填序号)。
a.混合气体的温度不再改变 b.2v正(N2O4)=v逆(NO2)
c.容器内气体颜色不再改变 d.容器内气体的密度不再改变
(6)化学平衡常数(K)是指一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡状态,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积的比值。例如:aA(g)+bB(g) pC(g)+qD(g) K=
pC(g)+qD(g) K= ,计算298K时,反应N2O4(g)
,计算298K时,反应N2O4(g)  2NO2(g)的平衡常数K=
2NO2(g)的平衡常数K=_______ 。
Ⅰ.已知下列反应在298K时的反应焓变:
①N2(g)+O2(g)=2NO(g) △H1=180.5 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-112 kJ·mol-1
③N2(g)+2O2(g)=N2O4(g) △H3=10.7 kJ·mol-1
(1)写出N2O4(g)转化为NO2(g)的热化学方程式:
Ⅱ.298K时,在2 L的恒容绝热密闭容器中发生反应:N2O4(g)

(2)代表NO2气体浓度随时间变化的曲线为
(3)当N2O4的浓度为0.08 mol·L-1时,反应时间为t s,则0~t s时,用NO2气体的浓度变化量表达该反应的平均速率为
(4)A、B两点对应时刻,反应速率大小:vA
(5)不能说明该反应达到平衡状态的是
a.混合气体的温度不再改变 b.2v正(N2O4)=v逆(NO2)
c.容器内气体颜色不再改变 d.容器内气体的密度不再改变
(6)化学平衡常数(K)是指一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡状态,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积的比值。例如:aA(g)+bB(g)
20-21高一下·山东潍坊·期末
类题推荐
I.某化学兴趣小组用50mL 0.50 mol·L-1盐酸与50mL 0.55 mol·L-1 NaOH溶液进行中和反应的反应热测定实验。记录的实验数据如表所示(已知:实验中盐酸和氢氧化钠溶液的密度均为1g·cm-3,中和反应结束后溶液的比热容c=4.18 J·g-1·℃-1)。
(1)依据实验数据计算,该反应的中和热ΔH为_______ 。如果将NaOH溶液换成等量的NaOH固体,那么实验中测得中和反应的反应热(ΔH)_______ (填 “偏大”“偏小”或“不变”)。
II.NO2和N2O4是氮的两种重要氧化物。已知下列反应在298K时的反应焓变:
①N2(g)+O2(g)=2NO(g) ΔH1 = +180.5 kJ·mol-1
②2NO(g)+O2(g) 2NO2(g) ΔH2 = -112 kJ·mol-1
2NO2(g) ΔH2 = -112 kJ·mol-1
③N2(g)+2O2(g)=N2O4(g) ΔH3 = +10.7 kJ·mol-1
(2)写出N2O4(g)转化为NO2(g) 的热化学方程式:_______ 。
(3)298K时,在2L的恒容绝热密闭容器中发生上述N2O4(g)转化为NO2(g)的反应,反应过程中各气体浓度随时间变化的情况如图所示。
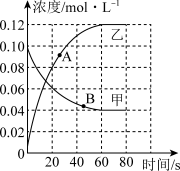
①代表NO2气体浓度随时间变化的曲线为_______ (填“甲”或“乙”)。
②当N2O4的浓度为0.08 mol·L-1时,反应时间为t s,则0~t s时,用NO2气体的浓度变化量表示该反应的平均速率为_______ 。
③A、B两点对应时刻,反应速率大小关系为:_______ 。
④不能说明该反应达到平衡状态的是_______ (填序号)。
a.混合气体的温度不再改变 b.2v正(N2O4)=v逆(NO2)
c.容器内气体颜色不再改变 d.容器内气体的密度不再改变
⑤化学平衡常数(K)是指一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡状态,这时各生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值。例如:aA(g) + bB(g) pC(g) + qD(g)
pC(g) + qD(g)  。计算298K时,上述N2O4(g)转化为NO2(g)的反应平衡常数K=
。计算298K时,上述N2O4(g)转化为NO2(g)的反应平衡常数K=_______ 。
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成可循环使用的氧化物N2O5。
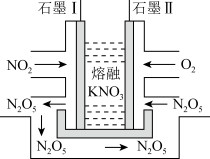
①放电时,该电池的负极是_______ (填“石墨I”或“石墨II”),其电极反应是为_______ 。
②若电路中有1 mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的O2_______ L。
| 实验 序号 | 起始温度T1/℃ | 终止温度T2/℃ | |
| 盐酸 | NaOH溶液 | 混合溶液 | |
| 1 | 20.0 | 20.2 | 23.3 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.4 | 20.6 | 23.8 |
(1)依据实验数据计算,该反应的中和热ΔH为
II.NO2和N2O4是氮的两种重要氧化物。已知下列反应在298K时的反应焓变:
①N2(g)+O2(g)=2NO(g) ΔH1 = +180.5 kJ·mol-1
②2NO(g)+O2(g)
③N2(g)+2O2(g)=N2O4(g) ΔH3 = +10.7 kJ·mol-1
(2)写出N2O4(g)转化为NO2(g) 的热化学方程式:
(3)298K时,在2L的恒容绝热密闭容器中发生上述N2O4(g)转化为NO2(g)的反应,反应过程中各气体浓度随时间变化的情况如图所示。

①代表NO2气体浓度随时间变化的曲线为
②当N2O4的浓度为0.08 mol·L-1时,反应时间为t s,则0~t s时,用NO2气体的浓度变化量表示该反应的平均速率为
③A、B两点对应时刻,反应速率大小关系为:
④不能说明该反应达到平衡状态的是
a.混合气体的温度不再改变 b.2v正(N2O4)=v逆(NO2)
c.容器内气体颜色不再改变 d.容器内气体的密度不再改变
⑤化学平衡常数(K)是指一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡状态,这时各生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值。例如:aA(g) + bB(g)
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成可循环使用的氧化物N2O5。

①放电时,该电池的负极是
②若电路中有1 mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的O2
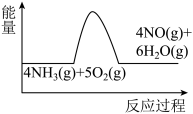
NO、NO2是空气中的污染物,将NO、NO2转化为N2(g)是化学工作者的重要研究课题,回答下列问题:
(1)已知反应Ⅰ: △H1=-180.5 kJ/mol
△H1=-180.5 kJ/mol
反应Ⅱ: △H2=+566 kJ/mol
△H2=+566 kJ/mol
反应Ⅲ: △H3=-1200 kJ/mol
△H3=-1200 kJ/mol
则反应Ⅳ: △H4=
△H4=___________ kJ/mol。
(2)已知NO和O2经反应a和反应b转化为NO2,其能量随反应进程的变化如图所示。

反应a:
 K1
K1
反应b:
 K2
K2
下列说法正确的是___________ (填标号)。
A.反应b的速率大小决定了NO2(g)的生成速率
B.2NO(g)+O2(g) 2NO2(g)的平衡常数K=K1+K2
2NO2(g)的平衡常数K=K1+K2
C.从热力学角度分析,2NO(g)+O2(g) 2NO2(g)能自发进行的原因是熵变的影响大于焓变的影响
2NO2(g)能自发进行的原因是熵变的影响大于焓变的影响
(3)已知
 。T℃时,将一定量的NO2(g)、N2O4(g)充入一个容积为2 L的恒容密闭容器中,各物质浓度随时间变化的关系如下表所示:
。T℃时,将一定量的NO2(g)、N2O4(g)充入一个容积为2 L的恒容密闭容器中,各物质浓度随时间变化的关系如下表所示:
①下列说法可以说明反应达到平衡状态的是___________ (填标号)。
A.混合气体的密度不再发生变化
B.NO2的体积分数不再发生变化
C.
D.混合气体的颜色不再发生变化
②5min时,v正(NO2)___________ (填“>”或“<”)v逆(NO2);0~10 min内,v(N2O4)___________ mol/(L·min);N2O4的平衡转化率为___________ 。
③在该温度下,K=___________ mol/L。
(1)已知反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
则反应Ⅳ:
(2)已知NO和O2经反应a和反应b转化为NO2,其能量随反应进程的变化如图所示。

反应a:
反应b:
下列说法正确的是
A.反应b的速率大小决定了NO2(g)的生成速率
B.2NO(g)+O2(g)
C.从热力学角度分析,2NO(g)+O2(g)
(3)已知
| 时间/min | 0 | 5 | 10 | 20 | 50 |
| c(NO2)/(mol/L) | 0.2 | c | 0.6 | 0.7 | 0.7 |
| c(N2O4)/(mol/L) | 0.6 | c | 0.4 | 0.35 | 0.35 |
A.混合气体的密度不再发生变化
B.NO2的体积分数不再发生变化
C.
D.混合气体的颜色不再发生变化
②5min时,v正(NO2)
③在该温度下,K=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网