解答题-原理综合题 适中0.65 引用3 组卷527
Na2SO3、 NaHSO3是常见的化工原料,常用作还原剂。
(1)25℃, H2SO3、 HSO 、SO
、SO 的物质的量分数[
的物质的量分数[ ]与pH的关系如下图所示。
]与pH的关系如下图所示。
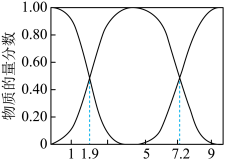
①若向NaOH溶液中通入SO2制取NaHSO3溶液,则当溶液的pH为_______ 时应停止通入。
②向NaOH溶液中通入SO2,所得溶液中一定存在的等式是_______ (用溶液中所含微粒的物质的量浓度表示)。
③结合数据说明NaHSO3溶液的酸碱性:_______ 。
(2)Na2SO3固体久置后会被氧化,为测定某久置Na2SO3固体中Na2SO3的含量,现进行如下实验:称取0.3000 g该固体于锥形瓶中,加水溶解后,边振荡边向其中滴加0.1000mol·L-1I2标准溶液28 mL,充分反应后,向溶液中滴加2滴淀粉溶液作指示剂,继续滴加0.1000 mol·L-1Na2S2O3标准溶液与过量的I2反应(发生反应I2+ 2Na2S2O3=2NaI+ Na2S4O6),恰好完全反应时消耗Na2S2O3标准溶液16 mL。
①滴定终点时的实验现象是_______ 。
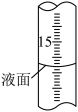
②滴定过程中,滴定管液面如图所示,此时滴定管的读数为_______ 。
③计算久置Na2SO3固体中Na2SO3的含量,并写出计算过程。_______
④下列情况会造成滴定或读取所滴Na2S2O3标准溶液体积偏大的是_______ (填序号)。
A.滴定过程中用蒸馏水冲洗锥形瓶瓶壁
B.装Na2S2O3标准溶液的滴定管水洗后未润洗
C.开始滴定时,滴定管尖嘴部分未充满液体
D.滴定前仰视读数,滴定后俯视读数
(1)25℃, H2SO3、 HSO

①若向NaOH溶液中通入SO2制取NaHSO3溶液,则当溶液的pH为
②向NaOH溶液中通入SO2,所得溶液中一定存在的等式是
③结合数据说明NaHSO3溶液的酸碱性:
(2)Na2SO3固体久置后会被氧化,为测定某久置Na2SO3固体中Na2SO3的含量,现进行如下实验:称取0.3000 g该固体于锥形瓶中,加水溶解后,边振荡边向其中滴加0.1000mol·L-1I2标准溶液28 mL,充分反应后,向溶液中滴加2滴淀粉溶液作指示剂,继续滴加0.1000 mol·L-1Na2S2O3标准溶液与过量的I2反应(发生反应I2+ 2Na2S2O3=2NaI+ Na2S4O6),恰好完全反应时消耗Na2S2O3标准溶液16 mL。
①滴定终点时的实验现象是
②滴定过程中,滴定管液面如图所示,此时滴定管的读数为

③计算久置Na2SO3固体中Na2SO3的含量,并写出计算过程。
④下列情况会造成滴定或读取所滴Na2S2O3标准溶液体积偏大的是
A.滴定过程中用蒸馏水冲洗锥形瓶瓶壁
B.装Na2S2O3标准溶液的滴定管水洗后未润洗
C.开始滴定时,滴定管尖嘴部分未充满液体
D.滴定前仰视读数,滴定后俯视读数
21-22高二下·江苏南通·开学考试
类题推荐
I.用标准0.1000mol/L的NaOH溶液滴定未知浓度的盐酸,选用甲基橙作为指示剂,请你回答下列问题:
(1)标准液应装在_______ 式滴定管中,达到滴定终点时的现象为_______ 。
(2)滴定时实验数据如下表所示:

滴定后滴定管读数_______ ml,求这种待测稀盐酸的物质的量浓度c(HCl)=_______ mol/L。
(3)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是 。
(4)大量的碘富集在海藻中,用水浸取后浓缩。浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 =
=_______ 。(已知Ksp(AgCl)=2×10-10,Ksp(AgI)=8.5×10-17)
(5)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=_______ mol/L;将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的 =
=_______ 。
(6)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中 ,则溶液显
,则溶液显_______ 性(填“酸”或“碱”或“中”);用含a的代数式表示 的电离常数Kb=
的电离常数Kb=_______ 。
(1)标准液应装在
(2)滴定时实验数据如下表所示:
| 实验次数编号 | 待测盐酸体积 | 滴入NaOH体积 |
| 1 | 20.00 mL | 21.90 mL |
| 2 | 20.00 mL | 21.70 mL |
| 3 | 20.00 mL | 见图 |

滴定后滴定管读数
(3)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是 。
| A.滴定终点读数时,俯视滴定管的刻度,其他操作正确 |
| B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 |
| C.滴定到终点读数时,滴定管尖嘴处有气泡 |
| D.配制标准溶液的NaOH固体中混有Na2CO3杂质 |
(5)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=
(6)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中
I.用标准0.1000mol/L的NaOH溶液滴定未知浓度的盐酸,选用甲基橙作为指示剂,请你回答下列问题:
(1)标准液达到滴定终点时的现象为_______ 。
(2)滴定时实验数据如下表所示:
_______ ml,求这种待测稀盐酸的物质的量浓度c(HCl)=_______ mol/L。
(3)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是_。
(4)大量的碘富集在海藻中,用水浸取后浓缩。浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 =
=_______ 。(已知Ksp(AgCl)=2×10-10,Ksp(AgI)=8.5×10-17)
(5)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8.若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=_______ mol/L;将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的 =
=_______ 。
(6)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中 ,则溶液显
,则溶液显_____ 性(填“酸”或“碱”或“中”);用含a的代数式表示 的电离常数Kb=
的电离常数Kb=______ 。
(1)标准液达到滴定终点时的现象为
(2)滴定时实验数据如下表所示:
| 实验次数编号 | 待测盐酸体积 | 滴入NaOH体积 |
| 1 | 20.00 mL | 21.90 mL |
| 2 | 20.00 mL | 21.70 mL |
| 3 | 20.00 mL | 见图 |
(3)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是_。
| A.滴定终点读数时,俯视滴定管的刻度,其他操作正确 |
| B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 |
| C.滴定到终点读数时,滴定管尖嘴处有气泡 |
| D.配制标准溶液的NaOH固体中混有Na2CO3杂质 |
(5)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8.若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=
(6)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中
I.用酸碱中和滴定法测定某烧碱的纯度。
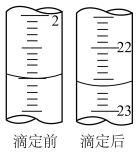
(1)滴定管的使用:图1是一支50ml的滴定管滴定后的液面的示数,读数为_______ ;

(2)配制待测液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。
①滴定时,先向锥形瓶中加2~3滴甲基橙作为指示剂;滴定过程中操作错误的有_______
a.滴定时眼睛应注视标准液的体积变化
b.锥形瓶中指示剂变色后立即读数
c.盛装标准液的滴定管,用蒸馏水洗过后,还需要用待测液润洗2~3次
d.滴定时可用蒸馏水将锥形瓶内壁上的待测液冲下
②0.2000mol/l的盐酸标准液滴定烧碱的有关数据记录如表:
纯度计算:烧碱样品的纯度为_______ 。(保留小数点后两位)
II.滴定实验是化学学科中最重要的定量实验之一。葡萄酒中抗氧化剂残留量的测定,常采用氧化还原滴定法。葡萄酒常用Na2S2O5作抗氧化剂,测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案:

往实验中加入盐酸的目的是将Na2S2O5转化成SO2;滴定过程中发生的反应是:SO2+I2+2H2O=2HI+H2SO4。
(3)该滴定过程的指示剂是_______ ,滴定终点的现象为_______ 。
(4)实验消耗标准I2溶液50.00ml,所测样品中抗氧化剂的残留量(以游离SO2计算)为_______ g/L。(结果保留小数点后两位)
(5)下列情形会造成测定结果偏高的有_______(填序号)。
(6)析中,沉淀滴定也是常见的方法。以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4为指示剂,利用Ag+与CrO 反应生成砖红色沉淀指示滴定终点。当溶液中Cl-恰好沉淀完全时,c(CrO
反应生成砖红色沉淀指示滴定终点。当溶液中Cl-恰好沉淀完全时,c(CrO )=
)=_______ mol/L。(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10;离子浓度小于10-5mol/L时认为沉淀完全)
(1)滴定管的使用:图1是一支50ml的滴定管滴定后的液面的示数,读数为

(2)配制待测液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。
①滴定时,先向锥形瓶中加2~3滴甲基橙作为指示剂;滴定过程中操作错误的有
a.滴定时眼睛应注视标准液的体积变化
b.锥形瓶中指示剂变色后立即读数
c.盛装标准液的滴定管,用蒸馏水洗过后,还需要用待测液润洗2~3次
d.滴定时可用蒸馏水将锥形瓶内壁上的待测液冲下
②0.2000mol/l的盐酸标准液滴定烧碱的有关数据记录如表:
| 滴定序号 | 待测液体积(mL) | 消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.60 |
| 2 | 20.00 | 3.00 | 22.90 |
| 3 | 20.00 | 0.00 | 22.10 |
II.滴定实验是化学学科中最重要的定量实验之一。葡萄酒中抗氧化剂残留量的测定,常采用氧化还原滴定法。葡萄酒常用Na2S2O5作抗氧化剂,测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案:

往实验中加入盐酸的目的是将Na2S2O5转化成SO2;滴定过程中发生的反应是:SO2+I2+2H2O=2HI+H2SO4。
(3)该滴定过程的指示剂是
(4)实验消耗标准I2溶液50.00ml,所测样品中抗氧化剂的残留量(以游离SO2计算)为
(5)下列情形会造成测定结果偏高的有_______(填序号)。
| A.滴定持续时间稍长,溶液中部分HI被空气氧化 |
| B.盛装标准I2溶液的滴定管用蒸馏水洗净后,未润洗 |
| C.滴定前平视,滴定后俯视 |
| D.滴定前滴定管尖嘴有气泡滴定后气泡消失 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


