解答题-原理综合题 较难0.4 引用3 组卷372
我国力争实现2030年前“碳达峰”、2060年前“碳中和”的目标,CO2的捕集、利用与封存成为科学家研究的重要课题。
(1)CO2甲烷化反应最早由化学家Paul Sabatier提出。已知:
反应I:CO2(g)+H2(g) CO(g)+H2O(g) △H =+41.2kJ·mol-1
CO(g)+H2O(g) △H =+41.2kJ·mol-1
反应Ⅱ:2CO(g)+2H2(g) CO2(g)+CH4(g)△H =-247.1kJ·mol-1
CO2(g)+CH4(g)△H =-247.1kJ·mol-1
①CO2甲烷化反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的△H =
CH4(g)+2H2O(g)的△H =_______ kJ·mol-1,为了提高甲烷的产率,反应适宜在_______ (填标号)条件下进行。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
②反应I:CO2(g)+H2(g) CO(g)+H2O(g) △H = +41.2kJ·mol-1,已知反应的
CO(g)+H2O(g) △H = +41.2kJ·mol-1,已知反应的 ,
, (
( 和
和 为速率常数,与温度、催化剂有关)。若平衡后升高温度,则
为速率常数,与温度、催化剂有关)。若平衡后升高温度,则
_______ (填“增大”“不变”或“减小”);若反应I在恒容绝热的容器中发生,下列情况下反应一定达到平衡状态的是_______ (填标号)。
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内c(CO2):c(H2):c(CO):c(H2O)=1:1:1:1
D.单位时间内,断开C=O的数目和断开H—O的数目相同
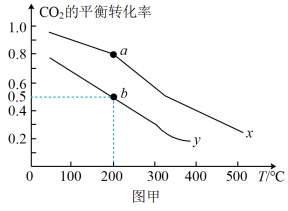
(2)在某催化剂表面发生如下反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),利用该反应可减少CO2排放,并合成清洁能源。一定条件下,在一密闭容器中充入2mol CO2和6mol H2发生反应,图甲表示压强为0.1MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。
CH3OH(g)+H2O(g),利用该反应可减少CO2排放,并合成清洁能源。一定条件下,在一密闭容器中充入2mol CO2和6mol H2发生反应,图甲表示压强为0.1MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。
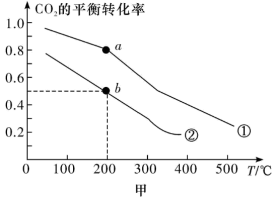
其中表示压强为5.0MPa下CO2的平衡转化率随温度的变化曲线为_______ (填“①”或“②”);b点对应的平衡常数 =
=_______ MPa-2( 为以平衡分压代替平衡浓度表示的平衡常数。分压=总压×物质的量分数)。
为以平衡分压代替平衡浓度表示的平衡常数。分压=总压×物质的量分数)。
(3)科研人员提出CeO2催化CO2合成碳酸二甲酯(DMC),从而实现CO2的综合利用。图乙为理想的CeO2的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷(如图丙)。
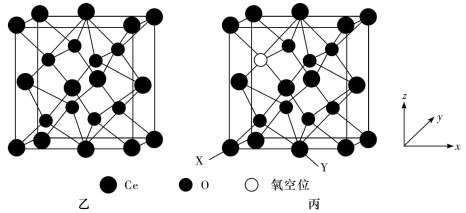
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知:CeO2缺陷晶型中X处原子的分数坐标为(0,0,0),Y处原子的分数坐标为 ,则氧空位处原子的分数坐标为
,则氧空位处原子的分数坐标为_______ ,该缺陷晶型的化学式可表示为_______ 。
②设阿伏加德罗常数的值为 ,晶胞参数为apm,CeO2理想晶型的密度为
,晶胞参数为apm,CeO2理想晶型的密度为_______ g·cm-3(列出表达式)。
(1)CO2甲烷化反应最早由化学家Paul Sabatier提出。已知:
反应I:CO2(g)+H2(g)
反应Ⅱ:2CO(g)+2H2(g)
①CO2甲烷化反应CO2(g)+4H2(g)
A.高温高压 B.高温低压 C.低温高压 D.低温低压
②反应I:CO2(g)+H2(g)
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内c(CO2):c(H2):c(CO):c(H2O)=1:1:1:1
D.单位时间内,断开C=O的数目和断开H—O的数目相同
(2)在某催化剂表面发生如下反应CO2(g)+3H2(g)

其中表示压强为5.0MPa下CO2的平衡转化率随温度的变化曲线为
(3)科研人员提出CeO2催化CO2合成碳酸二甲酯(DMC),从而实现CO2的综合利用。图乙为理想的CeO2的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷(如图丙)。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知:CeO2缺陷晶型中X处原子的分数坐标为(0,0,0),Y处原子的分数坐标为
②设阿伏加德罗常数的值为
22-23高三上·湖南长沙·阶段练习
类题推荐
我国力争2030年前实现碳达峰, 的捕集、利用已成为科学家研究的热点。
的捕集、利用已成为科学家研究的热点。 在固体催化剂表面加氢合成甲烷过程中发生如下反应:
在固体催化剂表面加氢合成甲烷过程中发生如下反应:
主反应Ⅰ:

副反应Ⅱ:

(1) 的
的
___________  ,从化学平衡移动的角度分析,为了提高甲烷的产率,反应适宜在
,从化学平衡移动的角度分析,为了提高甲烷的产率,反应适宜在___________ 条件下进行。
A.低温、低压 B.低温、高压 C.高温、高压 D.高温、低压
(2)若在恒容绝热的容器中只发生副反应Ⅱ,下列能说明该反应一定达到平衡状态的是___________。
(3)在一定条件下,在某催化剂作用下,向恒容密闭容器中充入一定量的 和
和 ,若只发生主反应Ⅰ,测得在相同时间内,不同温度下
,若只发生主反应Ⅰ,测得在相同时间内,不同温度下 的转化率如图所示,已知
的转化率如图所示,已知 时已达平衡状态。
时已达平衡状态。
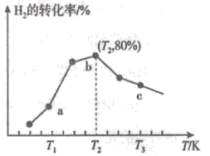
①a点
___________  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
②c点的转化率比b点低的原因是___________ ;
③温度为 时,将等物质的量的
时,将等物质的量的 和
和 充入体积为1L的密闭容器中,若只发生主反应Ⅰ,该反应的平衡常数K=2.实验测得:
充入体积为1L的密闭容器中,若只发生主反应Ⅰ,该反应的平衡常数K=2.实验测得: 、
、 ,
, 、
、 为速率常数。温度为
为速率常数。温度为 ,达平衡时:
,达平衡时: ,则
,则
___________ (填“>”、“<”或“=”) 。
。
(4)500℃时,向IL恒容密闭容器中充入 和
和 ,初始压强为p,20min时主、副反应都达到平衡状态,测得
,初始压强为p,20min时主、副反应都达到平衡状态,测得 ,体系压强为
,体系压强为 ,则0~20min内
,则0~20min内
___________  ;500℃,副反应Ⅱ的压强平衡常数Kp=
;500℃,副反应Ⅱ的压强平衡常数Kp=___________ (用平衡分压代替平衡浓度来计算,分压=总压×物质的量分数,计算结果保留2位有效数字)。
主反应Ⅰ:
副反应Ⅱ:
(1)
A.低温、低压 B.低温、高压 C.高温、高压 D.高温、低压
(2)若在恒容绝热的容器中只发生副反应Ⅱ,下列能说明该反应一定达到平衡状态的是___________。
| A.容器内气体密度不再改变 |
| B.容器内的压强不再改变 |
| C.容器内 |
| D.单位时间内,断开H-H键的数目和断开H-O键的数目之比为1∶2 |

①a点
②c点的转化率比b点低的原因是
③温度为
(4)500℃时,向IL恒容密闭容器中充入
为减少CO2排放、科学家着眼于能源转换和再利用等问题。
(1)CO2甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。
①已知部分共价键键能如表。
则反应CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)的∆H=_______ kJ•mol-1。
②向刚性绝热密闭容器中充入等物质的量的CO2(g)和H2(g)发生上述反应,下列可说明反应已达平衡状态的是_______ (填编号)。
A.容器内温度不变 B.混合气体平均密度保持不变
C.CH4的体积分数保持不变 D.v正(CO2)=v逆(H2O)
(2)CO2与H2在某催化剂表面制甲醇的化学方程式是:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g) ∆H<0。
①320℃时,CO2与H2按体积比1:4投入到刚性密闭容器中,同时加入催化剂发生合成甲醇的反应,测得初始时压强为p,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为_______ 。
②若将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H<0。图甲表示压强为0.1 MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。
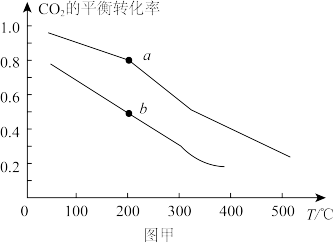
a、b两点正反应速率分别用va、vb表示,则va_______ vb(填“大于”、“小于”或“等于”)。
b点对应的平衡常数Kp=_______ MPa-2(Kp为以平衡分压代替平衡浓度表示的平衡常数。分压=总压×物质的量分数)。
(3)我国科学家用S-In催化剂电催化还原CO2制甲酸的机理如图乙所示,其中吸附在催化剂表面的原子用*标注。
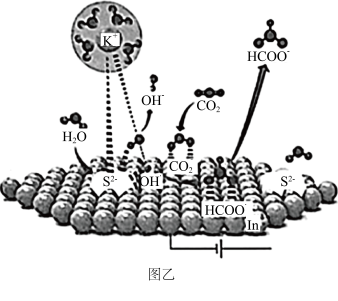
①图乙中,催化剂S2-活性位点在催化过程中的作用是_______ 。
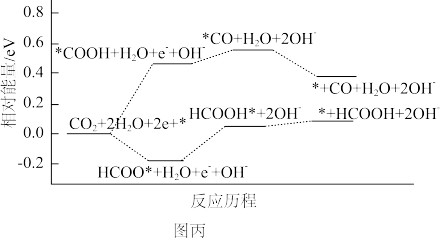
②图丙为催化还原CO2的反应历程图。其中,生成甲酸的决速步骤的电极反应式为_______ ,从反应能垒角度分析该催化剂对生成甲酸具有高选择性的原因:_______ 。
(1)CO2甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。
①已知部分共价键键能如表。
| 化学键 | C=O | C-H | H-H | H-O |
| 键能/kJ•mol-1 | 745.0 | 413.4 | 436.0 | 462.8 |
②向刚性绝热密闭容器中充入等物质的量的CO2(g)和H2(g)发生上述反应,下列可说明反应已达平衡状态的是
A.容器内温度不变 B.混合气体平均密度保持不变
C.CH4的体积分数保持不变 D.v正(CO2)=v逆(H2O)
(2)CO2与H2在某催化剂表面制甲醇的化学方程式是:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g) ∆H<0。
①320℃时,CO2与H2按体积比1:4投入到刚性密闭容器中,同时加入催化剂发生合成甲醇的反应,测得初始时压强为p,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为
②若将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H<0。图甲表示压强为0.1 MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。

a、b两点正反应速率分别用va、vb表示,则va
b点对应的平衡常数Kp=
(3)我国科学家用S-In催化剂电催化还原CO2制甲酸的机理如图乙所示,其中吸附在催化剂表面的原子用*标注。

①图乙中,催化剂S2-活性位点在催化过程中的作用是
②图丙为催化还原CO2的反应历程图。其中,生成甲酸的决速步骤的电极反应式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网