解答题-工业流程题 适中0.65 引用1 组卷159
海带、紫菜等藻类植物中含有丰富的碘元素,海带提碘的实验流程如下:

(1)步骤①中用到的硅酸盐材质的仪器为_______ (写名称)。
(2)步骤③用酸化的H2O2氧化I- 的离子方程式为_______ 。
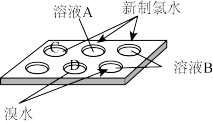
(3)实验小组根据元素周期律研究氧化I- 的氧化剂 (见下图),A、B两种盐溶液分别为_______ 、_______ , 添加C、D两处溶液的作用是_______ 。实验得出结论:氧化性强弱为Cl2>Br2>I2
(4)实验小组还设计了下表实验,对金属阳离子氧化I- 进行研究。
已知:常温下,CuI(白色)、AgI(黄色)的Ksp分别为
①实验2中a为_______ 溶液。
甲同学根据现象得出结论:Ag+氧化性比Cu2+弱且不能氧化I-。
乙同学对甲同学的结论提出质疑,查阅资料(常温下,反应2Ag+(aq)+2I-(aq)⇌2Ag(s)+I2(aq)的平衡常数 ,当c(Ag+)、c(I-)大于等于1mol·L-1时,Ag+可以氧化I-),借助原电池原理优化实验设计,证实了自己的观点。
,当c(Ag+)、c(I-)大于等于1mol·L-1时,Ag+可以氧化I-),借助原电池原理优化实验设计,证实了自己的观点。
②请你补充画完整原电池装置示意图(如图),并作相应标注_______ 。

③根据以上实验过程,试分析实验2中Ag+ 没能氧化I- 的可能原因是_______ 。

(1)步骤①中用到的硅酸盐材质的仪器为
(2)步骤③用酸化的H2O2氧化I- 的离子方程式为
(3)实验小组根据元素周期律研究氧化I- 的氧化剂 (见下图),A、B两种盐溶液分别为

(4)实验小组还设计了下表实验,对金属阳离子氧化I- 进行研究。
已知:常温下,CuI(白色)、AgI(黄色)的Ksp分别为
| 序号 | 实验步骤 | 实验现象 | 结论 |
| 1 | 往CuSO4溶液中滴加KI溶液,然后加入少量苯,振荡 | 产生白色沉淀,溶液分层,上层为紫红色 | Cu2+可以氧化I- 为I2 |
| 2 | 往AgNO3中滴加KI溶液,滴加几滴a溶液,振荡 | 产生黄色沉淀,溶液无色 | Ag+与I-只发生沉淀反应 |
甲同学根据现象得出结论:Ag+氧化性比Cu2+弱且不能氧化I-。
乙同学对甲同学的结论提出质疑,查阅资料(常温下,反应2Ag+(aq)+2I-(aq)⇌2Ag(s)+I2(aq)的平衡常数
②请你补充画完整原电池装置示意图(如图),并作相应标注

③根据以上实验过程,试分析实验2中Ag+ 没能氧化I- 的可能原因是
22-23高三上·广东佛山·阶段练习
类题推荐
某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强,数值越小,还原性越强。
测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度均为0.1mol•L-1的下列三种溶液,氧化性由强到弱的顺序为_____ (填序号)。
①FeCl3 ②酸性KMnO4 ③酸性NaNO3
(2)影响物质氧化性强弱的因素有_____ 、_____ 。
(3)已知Fe3+与I-不能共存,由此推测下列一定不能大量共存的离子组是_____ 。
a.Fe3+、Br- b.Fe3+、S2- c.NO 、H+、I- d.H+、MnO
、H+、I- d.H+、MnO 、I-
、I-
(4)向等浓度的NaBr和KI混合溶液滴加少量酸性KMnO4溶液,发生反应的离子方程式为_____ 。(已知MnO 在酸性环境下的产物为Mn2+)
在酸性环境下的产物为Mn2+)
(5)往淀粉-KI溶液中逐滴加入氯水,观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。
猜想1:______。
猜想2:I2被氯水继续氧化
查阅资料:HClO不能漂白淀粉与I2结合形成的蓝色物质。
①猜想1为______ ,实验1所用试剂a为______ ,实验1的现象为______ 。
②实验3所用试剂b是一种可溶性含碘化合物,该反应的离子方程式为______ 。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强,数值越小,还原性越强。
测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 | H2O2 | H2O2(酸化) | FeCl3 | KMnO4(酸化) | NaNO3(酸化) | NaBr | KI | Na2S |
| 浓度 | 5% | 5% | 0.1mol•L-1 | |||||
| 电位值/mV | 276 | 683 | 671 | 1130 | 603 | 362 | 116 | -361 |
(1)浓度均为0.1mol•L-1的下列三种溶液,氧化性由强到弱的顺序为
①FeCl3 ②酸性KMnO4 ③酸性NaNO3
(2)影响物质氧化性强弱的因素有
(3)已知Fe3+与I-不能共存,由此推测下列一定不能大量共存的离子组是
a.Fe3+、Br- b.Fe3+、S2- c.NO
(4)向等浓度的NaBr和KI混合溶液滴加少量酸性KMnO4溶液,发生反应的离子方程式为
(5)往淀粉-KI溶液中逐滴加入氯水,观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。
猜想1:______。
猜想2:I2被氯水继续氧化
查阅资料:HClO不能漂白淀粉与I2结合形成的蓝色物质。
| 序号 | 实验操作 | 试剂 | 现象 | 结论 |
| 1 | 分别取少量褪色的溶液于三支试管中,并加入对应试剂,观察实验现象 | a | ______ | 猜想1不正确 |
| 2 | 淀粉溶液 | 溶液不变蓝 | 猜想2正确(I2被氧化为IO | |
| 3 | b+稀H2SO4 | 溶液变蓝 |
②实验3所用试剂b是一种可溶性含碘化合物,该反应的离子方程式为
某小组验证2Fe3++2I-⇌2Fe2++I2(反应A)存在限度,实现Fe2+与Fe3+的相互转化
Ⅰ.从正反应方向探究:
(1)为了验证“实验1”反应的发生,加入CCl4充分振荡,出现___________ 现象,证明反应的发生;
(2)“实验1”中可通过检验___________ (填离子符号),证实该反应存在限度;
(3)“实验2”溶液无明显变化可能由于离子浓度太低无法检出,如果再加适量新制氯水将观察到溶液变为红色,该过程发生的氧化还原反应离子方程式为___________ ;
Ⅱ.从逆反应方向探究:
(4)同学们对“实验4”的现象有各种推测
①甲同学认为:加入Ag2SO4溶液可增大Fe2+与I2的反应程度,产生的沉淀是___________ (填化学式),甲同学依据的原理是___________ ;
②乙同学查阅资料知:3I2+ 3H2O⇌5HI+HIO3,认为碘水中含有I-,加入Ag2SO4溶液也可能产生沉淀,设计如下实验,通过对比、检验沉淀成分,从而明确Ag2SO4在反应A中的作用。
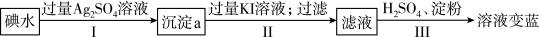
(已知:Ksp(AgI)=8.5 × 10-17、Ksp(AgIO3)=3.2×10-8 (微溶)
根据以上实验现象,确定沉淀a的成分是:___________ (填化学式);Ⅲ中发生反应的离子方程式是___________ 。
(5)问题与思考:有同学提出Fe2+与Ag+之间是否发生反应Ag++Fe2+=Fe3++Ag↓;并设计电化学装置进行验证。请补全电化学装置示意图___________ ,写出操作、现象及结论___________ 。

Ⅰ.从正反应方向探究:
| 编号 | 实验操作 | 现象 |
| 1 | 取5mL 0.01mol·L-1 KI溶液,加入2mL 0.005mol·L-1Fe2(SO4)3溶液(pH=1) | 溶液变为棕黄色 |
| 2 | 向“实验1”溶液中滴加1-2滴KSCN溶液 | 溶液无明显变化 |
(2)“实验1”中可通过检验
(3)“实验2”溶液无明显变化可能由于离子浓度太低无法检出,如果再加适量新制氯水将观察到溶液变为红色,该过程发生的氧化还原反应离子方程式为
Ⅱ.从逆反应方向探究:
| 编号 | 实验操作 | 现象 |
| 3 | 碘水(含淀粉)中加入酸性FeSO4溶液 | 溶液保持蓝色,无明显变化 |
| 4 | 碘水(含淀粉)中加入酸性FeSO4,溶液,再加入足量Ag2SO4溶液 | 产生沉淀,溶液蓝色褪去 |
①甲同学认为:加入Ag2SO4溶液可增大Fe2+与I2的反应程度,产生的沉淀是
②乙同学查阅资料知:3I2+ 3H2O⇌5HI+HIO3,认为碘水中含有I-,加入Ag2SO4溶液也可能产生沉淀,设计如下实验,通过对比、检验沉淀成分,从而明确Ag2SO4在反应A中的作用。
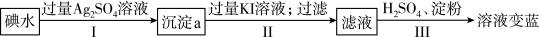
(已知:Ksp(AgI)=8.5 × 10-17、Ksp(AgIO3)=3.2×10-8 (微溶)
根据以上实验现象,确定沉淀a的成分是:
(5)问题与思考:有同学提出Fe2+与Ag+之间是否发生反应Ag++Fe2+=Fe3++Ag↓;并设计电化学装置进行验证。请补全电化学装置示意图

某学习小组做了如下实验探究海带中碘元素的存在形式,探究过程如图:
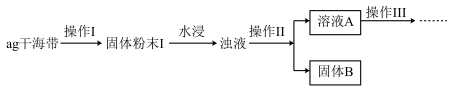
(1)操作I为灼烧,则灼烧时应该用___ (仪器名称)盛装海带,操作II为___ ;
(2)水浸时通常要将悬浊液煮沸2-3min,目的是___ 。
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
推测:①以IO 形式存在②以I-形式存在
形式存在②以I-形式存在
查阅资料:IO 具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
限选试剂:3%H2O2溶液、KSCN溶液、FeC12溶液、稀硫酸
(4)取20mL稀释后溶液A于锥形瓶,滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;已知在酸性条件下,MnO 的还原产物为Mn2+,写出离子方程式
的还原产物为Mn2+,写出离子方程式___ 。

(1)操作I为灼烧,则灼烧时应该用
(2)水浸时通常要将悬浊液煮沸2-3min,目的是
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
推测:①以IO
查阅资料:IO
限选试剂:3%H2O2溶液、KSCN溶液、FeC12溶液、稀硫酸
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再 用硫酸酸化,分装于试管I、II | 无现象 | |
| ② | 往试管I中加入FeC12溶液,然后加入2滴KSCN溶液并振荡; | 证明不是以IO | |
| ③ | 往试管II中加入 | 证明以I-形式存在 |
(4)取20mL稀释后溶液A于锥形瓶,滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;已知在酸性条件下,MnO
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


