计算题 适中0.65 引用1 组卷333
利用盖斯定律书写热化学方程式。
(1)根据已知信息,按要求写出指定反应的热化学方程式:
(1)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)=2LiH(s) ΔH=-182kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1
③4Li(s)+O2(g)=2Li2O(s) ΔH=-1196kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式_______ 。
(2)CH4—CO2催化重整反应为CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol-1
C(s)+ O2(g)=CO(g) ΔH=-111kJ·mol-1
O2(g)=CO(g) ΔH=-111kJ·mol-1
该催化重整反应的ΔH=_______ kJ·mol-1。
(3)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为_______ 、_______ ,制得等量H2所需能量较少的是_______ 。
(4)已知下列反应:
SO2(g)+2OH—(aq)= (aq)+H2O(l) ΔH1
(aq)+H2O(l) ΔH1
ClO—(aq)+ (aq)=
(aq)= (aq)+Cl—(aq) ΔH2
(aq)+Cl—(aq) ΔH2
CaSO4(s)=Ca2+(aq)+ (aq) ΔH3
(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH—(aq)=CaSO4(s)+H2O(l)+Cl—(aq)的ΔH=_______ 。
(1)根据已知信息,按要求写出指定反应的热化学方程式:
(1)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)=2LiH(s) ΔH=-182kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1
③4Li(s)+O2(g)=2Li2O(s) ΔH=-1196kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式
(2)CH4—CO2催化重整反应为CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol-1
C(s)+
该催化重整反应的ΔH=
(3)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为
(4)已知下列反应:
SO2(g)+2OH—(aq)=
ClO—(aq)+
CaSO4(s)=Ca2+(aq)+
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH—(aq)=CaSO4(s)+H2O(l)+Cl—(aq)的ΔH=
22-23高二上·河南南阳·阶段练习
类题推荐
回答下列问题
(1)用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如下图所示的催化循环实现。
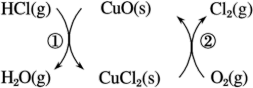
其中,反应①为2HCl(g)+CuO(s) = H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2的反应热为ΔH2,则总反应的热化学方程式为______________ (反应热用ΔH1和ΔH2表示)。
(2)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是____________ 。
(3)已知:温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol-1
贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为______ 。
(4)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1 kJ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为___________ 。
(5)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) = CH3OH(g) ΔH1
②CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) = CO(g)+H2O(g) ΔH3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
由此计算ΔH1=________ kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________ kJ·mol-1。
(6)已知:① H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol
② 断开1mol H2分子中的化学键需要吸收436kJ的能量
③ 断开1mol Cl2分子中的化学键需要吸收243kJ的能量
则:断开1mol HCl分子中的化学键需要吸收______ kJ的能量。
(1)用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如下图所示的催化循环实现。
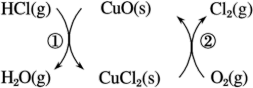
其中,反应①为2HCl(g)+CuO(s) = H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2的反应热为ΔH2,则总反应的热化学方程式为
(2)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
(3)已知:温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol-1
贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为
(4)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1 kJ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
(5)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) = CH3OH(g) ΔH1
②CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) = CO(g)+H2O(g) ΔH3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(6)已知:① H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol
② 断开1mol H2分子中的化学键需要吸收436kJ的能量
③ 断开1mol Cl2分子中的化学键需要吸收243kJ的能量
则:断开1mol HCl分子中的化学键需要吸收
完成下列小题
(1)①如图表示某反应的能量变化关系图,该反应的△H=_____ kJ/mol(用a~e表示)。

②已知:2H2(g)+O2(g)=2H2O(g)△H=—484kJ/mol,则表中x=_____ 。
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

系统(Ⅰ)的热化学方程式为:H2O(l)=H2(g)+ O2(g)△H=
O2(g)△H=_____ ;系统(Ⅱ)的热化学方程式为:_____ 。
(3)工业上,常采用“加碳氯化”的方法以TiO2为原料生产TiCl4,相关反应为:
i、
ii、
①TiO2(s)加炭氯化生成TiCl4(g)和CO(g)的热化学方程式为:_____ 。
②TiO2氯化过程中加碳的作用是为_____ 和_____ 。
(1)①如图表示某反应的能量变化关系图,该反应的△H=

②已知:2H2(g)+O2(g)=2H2O(g)△H=—484kJ/mol,则表中x=
| 化学键 | H—H | O=O | O—H |
| 键能(kJ∙mol-1) | 436 | x | 463 |

系统(Ⅰ)的热化学方程式为:H2O(l)=H2(g)+
(3)工业上,常采用“加碳氯化”的方法以TiO2为原料生产TiCl4,相关反应为:
i、
ii、
①TiO2(s)加炭氯化生成TiCl4(g)和CO(g)的热化学方程式为:
②TiO2氯化过程中加碳的作用是为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


