解答题-原理综合题 适中0.65 引用2 组卷183
环境保护是当今社会的热门问题,而氮的氧化物是大气污染的主要物质,研究氮的氧化物的反应对于减少污染有重要意义。请根据所学化学知识回答下列问题:
(1)汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成N2,可有效降低汽车尾气污染。已知:
N2(g)+O2(g) 2NO(g) △H=+180.5 kJ·mol-1
2NO(g) △H=+180.5 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221.0 kJ·mol-1
2CO(g) △H=-221.0 kJ·mol-1
则尾气转化反应2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=___________ kJ·mol-1
(2)向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
①下列事实能说明反应达平衡状态的是___________ (填序号)
A.容器内气体的压强不变
B.容器内气体的密度不变
C.容器内气体的平均相对分子质量不变
②计算此温度下,该反应的平衡常数K=___________ L·mol-1。
③保持温度和容积不变,向平衡体系中再充入NO和N2,使二者浓度均增加至原来的两倍,此时平衡移动___________ (填“向正反应方向”“向逆反应方向”或“不”)。
④实验测得,v正=k正・c2(NO)・c2(CO),v逆=k逆•c2(N2)·c (CO2)、(k正、k逆为速率常数,只与温度有关)。达到平衡后,仅升高温度,k正增大的倍数___________ (填“>”“<”或“=")k逆增大的倍数。
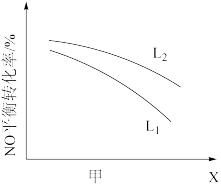
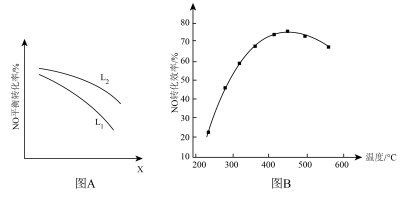
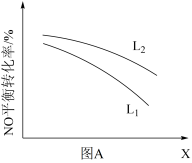
⑤L、X可分别代表压强或温度。图甲表示L一定时,NO(g)的平衡转化率随X的变化关系,则X代表___________ 。判断L1、L2的大小关系,并简述理由:___________
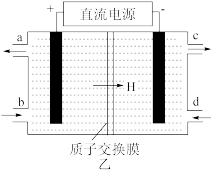
(3)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成NO 和NO
和NO 。可采用电解法将上述吸收液中的NO
。可采用电解法将上述吸收液中的NO 转化为无毒物质,同时再生Ce4+,其原理如图乙所示。写出阴极的电极反应式
转化为无毒物质,同时再生Ce4+,其原理如图乙所示。写出阴极的电极反应式___________ 。
(1)汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成N2,可有效降低汽车尾气污染。已知:
N2(g)+O2(g)
C(s)+O2(g)
2C(s)+O2(g)
则尾气转化反应2NO(g)+2CO(g)
(2)向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(NO)/(10-3 mol·L-1) | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
| c(CO)/(10-3 mol·L-1) | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
①下列事实能说明反应达平衡状态的是
A.容器内气体的压强不变
B.容器内气体的密度不变
C.容器内气体的平均相对分子质量不变
②计算此温度下,该反应的平衡常数K=
③保持温度和容积不变,向平衡体系中再充入NO和N2,使二者浓度均增加至原来的两倍,此时平衡移动
④实验测得,v正=k正・c2(NO)・c2(CO),v逆=k逆•c2(N2)·c (CO2)、(k正、k逆为速率常数,只与温度有关)。达到平衡后,仅升高温度,k正增大的倍数
⑤L、X可分别代表压强或温度。图甲表示L一定时,NO(g)的平衡转化率随X的变化关系,则X代表


(3)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成NO
22-23高三上·湖北·开学考试
类题推荐
机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1 =− 393.5kJ·mol−1
2C(s)+O2(g)=2CO(g) △H2 =− 221.0 kJ·mol−1
N2(g)+O2(g)=2NO(g) △H3 =+180.5 kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是___________ 。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如表:
①前4 s内的平均反应速率υ(CO) =___________ mol·L−1·s−1。
② L、X可分别代表压强或温度。如图,表示L一定时,NO(g)的平衡转化率随X的变化关系。
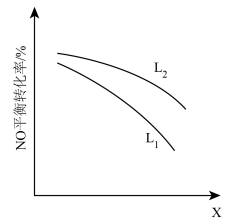
X代表的物理量是___________ 。判断:L1___________ L2的大小关系(填“>”、“<”或“=”),原因是:___________ 。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达平衡后,仅升高温度,k正增大的倍数___________ (填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________ 。(保留一位小数)
II.有人利用反应C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH = −34.0 kJ·mol−1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图所示。
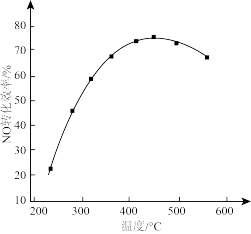
由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率___________ (填“是”或者“不是”)对应温度下的平衡转化率;高于450℃时,NO的转化率降低的可能原因是___________ (填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1 =− 393.5kJ·mol−1
2C(s)+O2(g)=2CO(g) △H2 =− 221.0 kJ·mol−1
N2(g)+O2(g)=2NO(g) △H3 =+180.5 kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10−4mol·L−1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10−3mol·L−1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
② L、X可分别代表压强或温度。如图,表示L一定时,NO(g)的平衡转化率随X的变化关系。

X代表的物理量是
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达平衡后,仅升高温度,k正增大的倍数
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =
II.有人利用反应C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH = −34.0 kJ·mol−1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图所示。

由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) =CO2(g) △H1=− 393.5kJ·mol−1
2C(s)+O2(g) =2CO(g) △H2=− 221.0 kJ·mol−1
N2(g)+O2(g) =2NO(g) △H 3 =+180.5 kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________ 。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
① 前4 s内的平均反应速率υ(CO) =______ mol·L−1·s−1。
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______ 。判断L1、L2的大小关系______ ,并简述理由:______________________________ 。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______ (填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________ 。(保留一位小数)
Ⅱ. 有人利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH = −34.0 kJ·mol−1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率
N2(g)+CO2(g) ΔH = −34.0 kJ·mol−1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______ (填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________ ;高于450OC时,NO的转化率降低的可能原因是___________ (填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) =CO2(g) △H1=− 393.5kJ·mol−1
2C(s)+O2(g) =2CO(g) △H2=− 221.0 kJ·mol−1
N2(g)+O2(g) =2NO(g) △H 3 =+180.5 kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10−4mol·L−1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10−3mol·L−1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是

(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =
Ⅱ. 有人利用反应C(s)+2NO(g)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1=− 393.5kJ·mol−1
2C(s)+O2(g) = 2CO(g) △H2=− 221.0 kJ·mol−1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_______ 。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
① 前4 s内的平均反应速率υ(CO) =______ mol·L−1·s−1。
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是___________ 。判断L1、L2的大小关系,并简述理由:_________ 。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________ (填“>”、“<”或 “=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =_____________ 。(保留一位小数)
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1=− 393.5kJ·mol−1
2C(s)+O2(g) = 2CO(g) △H2=− 221.0 kJ·mol−1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10−4mol·L−1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10−3mol·L−1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是

(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


