填空题 适中0.65 引用3 组卷282
合成氨技术的发明使工业化人工固氮成为现实。请回答下列问题:
(1)合成氨的反应为:2NH3(g) N2(g)+3H2(g),有关化学键的键能如表所示。
N2(g)+3H2(g),有关化学键的键能如表所示。
①该反应的反应热ΔH=_______ 。
②已知该反应的ΔS=198.9 J·mol−1·K−1,在下列哪些温度下反应能自发进行?_______ (填标号)
A.25℃ B.125℃ C.225℃ D.325℃
(2)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为3.0 mol。
①达平衡时,H2的转化率α=_______ 。
②已知平衡时,容器压强为8 MPa,则平衡常数Kp=_______ (用平衡分压代替浓度计算,分压=总压×物质的量分数)。
(3)利用电解原理,将氨转化为高纯氢气,其装置如图所示。
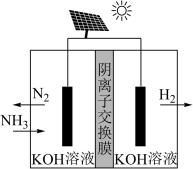
①阴极产生标准状况下112mL气体时,通过阴离子交换膜的离子的物质的量为_______ ;
②阳极的电极反应式为_______ 。
(1)合成氨的反应为:2NH3(g)
| 化学键 | |||
| 键能E/ kJ·mol−1 | 946 | 436.0 | 390.8 |
②已知该反应的ΔS=198.9 J·mol−1·K−1,在下列哪些温度下反应能自发进行?
A.25℃ B.125℃ C.225℃ D.325℃
(2)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为3.0 mol。
①达平衡时,H2的转化率α=
②已知平衡时,容器压强为8 MPa,则平衡常数Kp=
(3)利用电解原理,将氨转化为高纯氢气,其装置如图所示。

①阴极产生标准状况下112mL气体时,通过阴离子交换膜的离子的物质的量为
②阳极的电极反应式为
21-22高二上·福建宁德·期中
知识点:盖斯定律与热化学方程式根据△H=反应物的键能之和-生成物的键能之和进行计算化学平衡的有关计算电解池电极反应式及化学方程式的书写与判断 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
I.甲烷在化工领域中应用广泛,是一种重要能源。
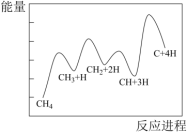
(1)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分____ 步进行,其中,第____ 步的正反应活化能最大。
(2)用甲烷催化还原氮氧化物可以消除氮氧化物污染,发生的主反应如下:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.0kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH1=-1160.0kJ•mol-1
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH3
则:ΔH3=____ kJ•mol-1
II.合成氨技术的发明使工业化人工固氮成为现实。请回答下列问题:
(3)合成氨的反应为:2NH3(g) N2(g)+3H2(g),有关化学键的键能如表所示。
N2(g)+3H2(g),有关化学键的键能如表所示。
该反应的反应热ΔH=____ 。
(4)在一定温度下,将1molN2和3molH2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为3.0mol。
①达平衡时,H2的转化率α=____ ,N2的体积分数为____ 。
②已知平衡时,容器内总压强为8MPa,则NH3的分压P(NH3)=____ MPa(已知分压=总压×物质的量分数)。
(1)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分

(2)用甲烷催化还原氮氧化物可以消除氮氧化物污染,发生的主反应如下:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.0kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH1=-1160.0kJ•mol-1
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH3
则:ΔH3=
II.合成氨技术的发明使工业化人工固氮成为现实。请回答下列问题:
(3)合成氨的反应为:2NH3(g)
| 化学键 | N≡N | H-H | N-H |
| 键能E/kJ•mol-1 | 946 | 436.0 | 390.8 |
该反应的反应热ΔH=
(4)在一定温度下,将1molN2和3molH2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为3.0mol。
①达平衡时,H2的转化率α=
②已知平衡时,容器内总压强为8MPa,则NH3的分压P(NH3)=
氨气中氢含量高,是一种优良的小分子储氢载体,可通过下面两种方法由氨气得到氢气。
方法I:氨热分解法制氢气
相关化学键的键能数据如下表所示:
一定温度下,利用催化剂将NH3分解为N2和H2。回答下列问题:
(1)反应2NH3(g) N2(g)+3H2(g) ΔH=
N2(g)+3H2(g) ΔH=_______ kJ·mol-1;已知该反应的ΔS=198.9J·mol-1·K-1,则在_______ (填“较高”或“较低”)温度下有利于该反应的自发进行。
(2)在一定温度和催化剂条件下,将0.1molNH3通入3L的容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
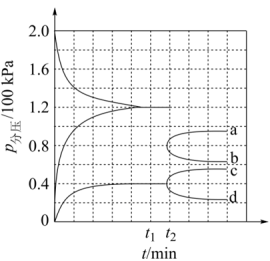
①若保持容器体积不变,t1时反应达到平衡,用N2的浓度变化表示0~t1时间内的反应速率v(N2)_______ (用含t1的代数式表示)。
②t2时将容器体积迅速缩小至原来的一半并保持不变,如图中能正确表示压缩后N2分压变化趋势的曲线是_______ (用图中a、b、c、d表示);说明理由:_______ 。
方法II:氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如如图所示。
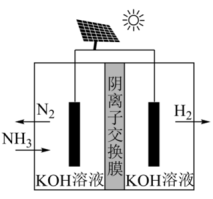
(3)阳极的电极反应式为_______ 。
方法I:氨热分解法制氢气
相关化学键的键能数据如下表所示:
| 化学键 | N | H-H | N-H |
| 键能E/(kJ·mol-1) | 945.8 | 436.0 | 390.8 |
一定温度下,利用催化剂将NH3分解为N2和H2。回答下列问题:
(1)反应2NH3(g)
(2)在一定温度和催化剂条件下,将0.1molNH3通入3L的容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变,t1时反应达到平衡,用N2的浓度变化表示0~t1时间内的反应速率v(N2)
②t2时将容器体积迅速缩小至原来的一半并保持不变,如图中能正确表示压缩后N2分压变化趋势的曲线是
方法II:氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如如图所示。

(3)阳极的电极反应式为
氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法I:氨热分解法制氢气
相关化学键的键能数据如下表所示:
一定温度下,利用催化剂将NH3分解为N2和H2。回答下列问题:
(1)反应2NH3(g) N2(g)+3H2(g) ΔH=
N2(g)+3H2(g) ΔH=_______ kJ·mol-1;已知该反应的ΔS=198.9J·mol-1·K-1,则在_______ (填“较高”或“较低”)温度下有利于该反应的自发进行。
(2)向容积为2L的恒容密闭容器中充入一定量的NH3,下列叙述能说明该反应已达到平衡状态的是_______(填标号)。
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂条件下,将0.1molNH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变,t1时反应达到平衡,用N2的浓度变化表示0~t1时间内的反应速率v(N2)_______ mol·L-1·min-1(用含t1的代数式表示)。
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是_______ (用图中a、b、c、d表示),理由是_______ ;
③在该温度下,用分压表示的该反应的平衡常数Kp=_______ 。(已知:分压=总压×该组分物质的量分数)。
方法II:氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如图所示。

(4)该装置中主要能量转化形式有_______ ;
(5)阳极的电极反应式为_______ 。
方法I:氨热分解法制氢气
相关化学键的键能数据如下表所示:
| 化学键 | N | H-H | N-H |
| 键能E/(kJ·mol-1) | 945.8 | 436.0 | 390.8 |
(1)反应2NH3(g)
(2)向容积为2L的恒容密闭容器中充入一定量的NH3,下列叙述能说明该反应已达到平衡状态的是_______(填标号)。
| A.容器内压强保持不变 |
| B.NH3(g)与N2(B)的物质的量之比为2:1 |
| C.气体的密度保持不变 |
| D.气体的平均相对分子质量保持不变 |

①若保持容器体积不变,t1时反应达到平衡,用N2的浓度变化表示0~t1时间内的反应速率v(N2)
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
③在该温度下,用分压表示的该反应的平衡常数Kp=
方法II:氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如图所示。

(4)该装置中主要能量转化形式有
(5)阳极的电极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


