填空题 适中0.65 引用1 组卷685
实验小组欲用0.5000mol•L-1标准NaOH溶液标定未知浓度的H2SO4溶液,其操作分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.5000mol•L-1标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④量取20.00mL待测液注入润洗过的锥形瓶中,并加入2滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的为_____ 个。
(2)排除碱式滴定管中气泡的方法应采用如图所示操作中的_____ (填序号)。
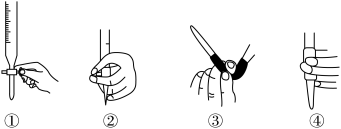
(3)步骤⑤滴定时眼睛应注视__________ ;到达滴定终点的现象是_____ 。
(4)以下是实验数据记录表:
根据表中数据计算该H2SO4溶液的物质的量浓度为_____ mol/L。
(5)下列操作可能使所测H2SO4溶液的浓度偏高的是_____ (填字母)。
①用蒸馏水洗涤碱式滴定管,注入0.5000mol•L-1标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④量取20.00mL待测液注入润洗过的锥形瓶中,并加入2滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的为
(2)排除碱式滴定管中气泡的方法应采用如图所示操作中的

(3)步骤⑤滴定时眼睛应注视
(4)以下是实验数据记录表:
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 2.20 | 18.40 |
| 3 | 20.00 | 2.00 | 18.16 |
(5)下列操作可能使所测H2SO4溶液的浓度偏高的是
| A.锥形瓶装液前,留有少量蒸馏水 |
| B.碱式滴定管盛装标准液前未润洗 |
| C.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| D.滴定过程中刚变色就立即停止滴定 |
21-22高二上·陕西咸阳·期末
类题推荐
某学生用0.2000mol∙L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol∙L-1的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记录读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入2~3滴酚酞试液;
⑤用标准NaOH溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的是___________ (填编号),该步骤错误操作会导致测定结果___________ (填“偏大”“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用___________ (填“酸式”或“碱式”)滴定管;在锥形瓶装液前,留有少量蒸馏水,测定结果___________ (填“偏大”“偏小”或“无影响”)。
(3)步骤⑤滴定时,眼睛应注视___________ ;判断达到滴定终点的依据是___________ 。
(4)以下是实验数据记录表:
从上表可以看出,第1次滴定记录的NaOH溶液体积明显大于后两次的体积,其可能的原因是___________ (填字母)。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,待测盐酸的物质的量浓度为___________ mol∙L−1。
①用蒸馏水洗涤碱式滴定管,注入0.2000mol∙L-1的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记录读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入2~3滴酚酞试液;
⑤用标准NaOH溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的是
(2)步骤④中,量取20.00mL待测液应使用
(3)步骤⑤滴定时,眼睛应注视
(4)以下是实验数据记录表:
| 滴定次数 | 盐酸体积/mL | NaOH溶液体积读数/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,待测盐酸的物质的量浓度为
某学生用0.2000mol∙L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol∙L-1的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记录读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入2~3滴酚酞试液;
⑤用标准NaOH溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的是___________ (填编号)。
(2)步骤④中,量取20.00mL待测液应使用___________ (填“酸式”或“碱式”)滴定管;在锥形瓶装液前,留有少量蒸馏水,测定结果___________ (填“偏大”“偏小”或“无影响”)。
(3)步骤⑤滴定时,眼睛应注视___________ 。
(4)以下是实验数据记录表:
从上表可以看出,第1次滴定记录的NaOH溶液体积明显大于后两次的体积,其可能的原因是____ (填字母)。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,待测盐酸的物质的量浓度为___________ mol∙L-1(按要求结果应保留4位有效数字)。
①用蒸馏水洗涤碱式滴定管,注入0.2000mol∙L-1的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记录读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入2~3滴酚酞试液;
⑤用标准NaOH溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的是
(2)步骤④中,量取20.00mL待测液应使用
(3)步骤⑤滴定时,眼睛应注视
(4)以下是实验数据记录表:
| 滴定次数 | 盐酸体积/mL | NaOH溶液体积读数/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,待测盐酸的物质的量浓度为
用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol/L的标准NaOH溶液至“0”刻度线以上;
②调节液面至“0”或“0”刻度线稍下,使滴定管尖嘴充满液体,并记下读数;
③量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
④用标准液滴定至终点,记下滴定管液面读数。
⑤再重复以上滴定操作3次。
请回答:
(1)以上步骤有错误的是(填编号)_______ 。
(2)步骤③中,量取20.00mL待测液应使用_______ (填仪器名称)。
(3)步骤④滴定时眼睛应注视_______ ;判断到达滴定终点的现象是:_______ 。
(4)实验数据记录表为
从表中可以看出,第1次滴定记录的NaOH溶液体积明显多于后三次的体积,其可能的原因是_______ 。
A.锥形瓶装液前,留有少量蒸馏水
B.滴定结束时,俯视读数
C.锥形瓶用待测液润洗
D.滴定过程中,少量标准溶液滴到锥形瓶外的滴定台上
(5)根据表中第2、3、4次记录数据计算,该盐酸浓度为_______ mol/L
①用蒸馏水洗涤碱式滴定管,注入0.2000mol/L的标准NaOH溶液至“0”刻度线以上;
②调节液面至“0”或“0”刻度线稍下,使滴定管尖嘴充满液体,并记下读数;
③量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
④用标准液滴定至终点,记下滴定管液面读数。
⑤再重复以上滴定操作3次。
请回答:
(1)以上步骤有错误的是(填编号)
(2)步骤③中,量取20.00mL待测液应使用
(3)步骤④滴定时眼睛应注视
(4)实验数据记录表为
| 滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 16.80 |
| 2 | 20.00 | 0.02 | 16.22 |
| 3 | 20.00 | 0.02 | 16.20 |
| 4 | 20.00 | 0.00 | 16.22 |
A.锥形瓶装液前,留有少量蒸馏水
B.滴定结束时,俯视读数
C.锥形瓶用待测液润洗
D.滴定过程中,少量标准溶液滴到锥形瓶外的滴定台上
(5)根据表中第2、3、4次记录数据计算,该盐酸浓度为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


