解答题-原理综合题 较难0.4 引用1 组卷54
碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)下列有关碳及其化合物的说法正确的是_______
(2)T温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g) 2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
2NO2(g) ∆H<0。不同时刻测得容器中n(NO2)如下表:
①升高温度K值_______ (增大、减小),T温度时化学平衡常数K=_______ mol-1·L。
②从0~2s该反应的平均速率v(NO2)=_______ 。
③对可逆反应2NO(g)+O2(g) 2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是
2NO2(g) ∆H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是_______ 。
A.混 合气体的密度不再变化 B.混合气体的压强不再变化
C.氧气的转化率不再变化 D.NO2、O2、NO的物质的量之比为2:1:2
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是_______ (写出主要反应的离子方程式),该溶液中,c(Na+)_______ 2c(SO )+c(HSO
)+c(HSO )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
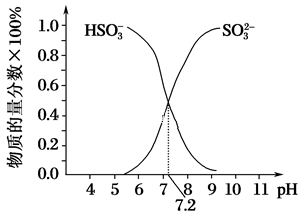
②在某NaHSO3、Na2SO3混合溶液中HSO 、SO
、SO 物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO
物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO 的第一步水解平衡常数=
的第一步水解平衡常数=_______ 。
(1)下列有关碳及其化合物的说法正确的是_______
| A.CO2是导致酸雨的主要气体 |
B.CO2的电子式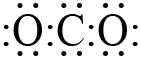 |
| C.金刚石、石墨与C60都是碳的同素异形体 |
| D.在高温条件下,碳能使CO2转变成CO |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①升高温度K值
②从0~2s该反应的平均速率v(NO2)=
③对可逆反应2NO(g)+O2(g)
A.混 合气体的密度不再变化 B.混合气体的压强不再变化
C.氧气的转化率不再变化 D.NO2、O2、NO的物质的量之比为2:1:2
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是
②在某NaHSO3、Na2SO3混合溶液中HSO

21-22高三上·宁夏银川·阶段练习
类题推荐
碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式____________ 。
(2)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)⇌2NO2(g) ∆H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
①从0~2s该反应的平均速率v(NO2)=___________ 。
②T1温度时化学平衡常数K=___________ mol-1·L。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________ 。若将容器的温度改变为T2时其k正=k逆,则T1__________ T2 (填“>”、“<”或“=”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是____________________ (写出主要反应的离子方程式),该溶液中,c(Na+)______ 2c( )+c(
)+c( )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
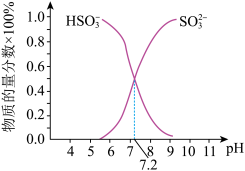
②在某NaHSO3、Na2SO3混合溶液中 、
、 物质的量分数随pH变化曲线如图所示(部分),根据图示,则
物质的量分数随pH变化曲线如图所示(部分),根据图示,则 的第一步水解平衡常数=
的第一步水解平衡常数=________ 。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式
(2)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)⇌2NO2(g) ∆H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=
②T1温度时化学平衡常数K=
③化学平衡常数K与速率常数k正、k逆的数学关系是K=
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是
②在某NaHSO3、Na2SO3混合溶液中

碳族、氮族元素及其化合物在生产、生活和环境保护中应用广泛。
(1)下列有关物质性质递变的描述中,正确的是________________ (填代号)。
A.酸性:HNO3>H2CO3>H2SiO3 B.稳定性:NH3>AsH3>PH3
C.稳定性:N2<P4(白磷) D.常温下,同浓度溶液的pH:Na3PO4<Na3AsO4
(2)已知:
(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①C(s)+2H2(g)=CH4(g) ΔH=___________ kJ·mol1。
②CH4制备合成气的原理是CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
A. 下列叙述不能表示该反应在恒温恒容条件下达到平衡状态的是____ 。
a. 混合气体的压强不再发生变化
b. 混合气体的密度不再发生变化
c. 反应容器中CO2、CO的物质的量的比值不再发生变化
d. 混合气体的平均相对分子质量不再发生变化
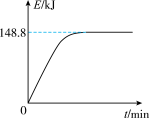
B. 若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为____________ 。
(3)在密闭容器中发生反应:2NO(g)+H2(g)= N2(g)+2H2O(g),其反应速率与浓度关系式为v=kcm(NO)·cn(H2)(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
总反应分两步进行:第i步,2NO+H2=N2+H2O2(很慢);第ii步,H2O2+H2=2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________ mol·L1·min1。
(4)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为
N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为_______ 。反应前后容器内气体压强之比为_________________________ 。
(1)下列有关物质性质递变的描述中,正确的是
A.酸性:HNO3>H2CO3>H2SiO3 B.稳定性:NH3>AsH3>PH3
C.稳定性:N2<P4(白磷) D.常温下,同浓度溶液的pH:Na3PO4<Na3AsO4
(2)已知:
(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①C(s)+2H2(g)=CH4(g) ΔH=
②CH4制备合成气的原理是CH4(g)+CO2(g)
A. 下列叙述不能表示该反应在恒温恒容条件下达到平衡状态的是
a. 混合气体的压强不再发生变化
b. 混合气体的密度不再发生变化
c. 反应容器中CO2、CO的物质的量的比值不再发生变化
d. 混合气体的平均相对分子质量不再发生变化
B. 若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为

(3)在密闭容器中发生反应:2NO(g)+H2(g)= N2(g)+2H2O(g),其反应速率与浓度关系式为v=kcm(NO)·cn(H2)(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
序数 | c(NO)/(mol·L1) | c(H2)/(mol·L1) | v/(mol·L1·min1) |
Ⅰ | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.20 | 0.20 | 3.312 |
Ⅲ | 0.10 | 0.20 | 0.828 |
(4)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应:2NO(g)+2CO(g)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



