解答题-原理综合题 适中0.65 引用1 组卷236
硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化:
 kJ·mol-1。回答问题:
kJ·mol-1。回答问题:
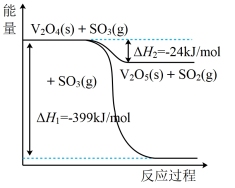
(1)钒催化剂参与反应的能量变化如图所示, 与
与 反应生成
反应生成 和
和 的热化学方程式为:
的热化学方程式为:___________ 。
(2)恒温恒容下,以 、
、 投料发生反应2SO2(g)+O2(g)
投料发生反应2SO2(g)+O2(g)  2SO3(g),下图分别代表焓变(
2SO3(g),下图分别代表焓变( )、混合气体平均相对分子(M )、
)、混合气体平均相对分子(M )、 质量分数
质量分数 和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是___________。
和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是___________。
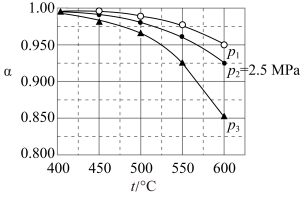
(3)向2L容器中充入2mol 和1mol
和1mol , 发生反应
, 发生反应 ,测得反应在不同温度和压强下,平衡混合物中
,测得反应在不同温度和压强下,平衡混合物中 体积分数如图所示。
体积分数如图所示。

①图中X表示___________ (填“温度”或“压强”),
___________  (填“>”或“<”);
(填“>”或“<”);
②
___________  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
③a点 的转化率为
的转化率为___________ ;a点对应的平衡常数
___________ ;
(1)钒催化剂参与反应的能量变化如图所示,

(2)恒温恒容下,以
A. | B.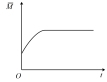 | C.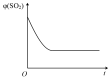 | D.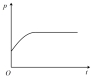 |

①图中X表示
②
③a点
22-23高二上·福建龙岩·阶段练习
类题推荐
硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ·mol-1,答下列问题:
2SO3(g) △H=-196.6kJ·mol-1,答下列问题:
(1)某温度下,在体积为2L的刚性密闭容器中投入2mol SO2和3.5mol O2,下图是n(SO2)和n(SO3)随时间变化曲线。
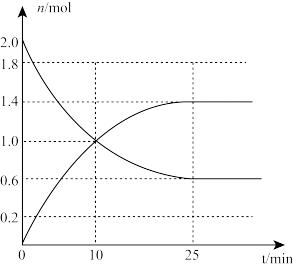
①0~10分钟SO3的平均速率v(SO3)=_______ 。
②反应达到平衡时,反应的平衡常数K=_______ (保留3位有效数字)。
③下列情况不能说明该反应达到化学平衡的是_______ 。
A. v(SO3)=2v(O2)
B. 混合气体的相对分子质量不再变化
C. t 时刻,体系的温度不再发生改变
D. 混合气体的密度保持不变
(2)下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
①从表中数据得出,最优的条件是_______ 。
②在实际生产中,选定的温度为400~500℃和常压(0.1MPa),原因是_______ 。
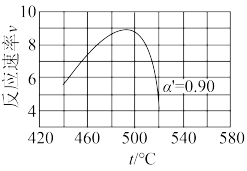
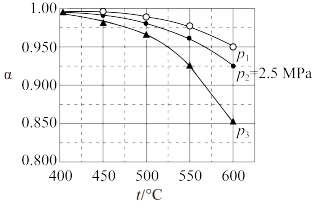
③当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2的平衡转化率α随温度的变化如下图所示。反应在5.0MPa、550℃时的α=_______ 。影响α的因素有温度、压强和_______ 。
(1)某温度下,在体积为2L的刚性密闭容器中投入2mol SO2和3.5mol O2,下图是n(SO2)和n(SO3)随时间变化曲线。

①0~10分钟SO3的平均速率v(SO3)=
②反应达到平衡时,反应的平衡常数K=
③下列情况不能说明该反应达到化学平衡的是
A. v(SO3)=2v(O2)
B. 混合气体的相对分子质量不再变化
C. t 时刻,体系的温度不再发生改变
D. 混合气体的密度保持不变
(2)下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
①从表中数据得出,最优的条件是
②在实际生产中,选定的温度为400~500℃和常压(0.1MPa),原因是
③当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2的平衡转化率α随温度的变化如下图所示。反应在5.0MPa、550℃时的α=

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网