解答题-原理综合题 适中0.65 引用1 组卷133
研究金属腐蚀和防腐的原理很有现实意义。
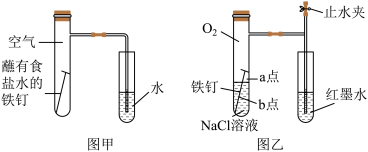
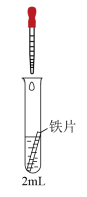
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有_______(填序号)。
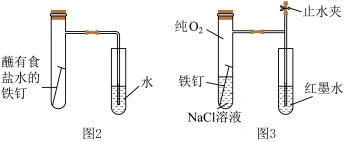
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐____ (填“加快”、“不变”、“减慢”),你认为影响因素为____ 。
(3)为探究铁钉腐蚀实验a、b两点所发生的反应,进行以下实验,请完成表格空白:
根据以上实验探究,试判断_______ (填“a”或“b”)为负极,该点腐蚀更严重。
(4)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,试写出该阳极电极反应式_______ 。

(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有_______(填序号)。
| A.用纯氧气代替试管内空气 | B.用酒精灯加热试管提高温度 |
| C.将铁钉换成铁粉和炭粉混合粉末 | D.换成更细的导管,水中滴加红墨水 |
| 时间/min | 1 | 3 | 5 | 7 | 9 |
| 液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
(3)为探究铁钉腐蚀实验a、b两点所发生的反应,进行以下实验,请完成表格空白:
| 实验操作 | 实验现象 | 实验结论 |
| 向NaCl溶液中滴加2~3滴酚酞指示剂 | a点附近溶液出现红色 | a点电极反应为① |
| 然后再滴加2~3滴K3[Fe(CN)6]溶液 | b点周围出现蓝色沉淀 | b点电极反应为② |
根据以上实验探究,试判断
(4)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,试写出该阳极电极反应式
22-23高二上·福建龙岩·阶段练习
类题推荐
I.研究金属腐蚀和防腐的原理很有现实意义。
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有______ (填序号)。
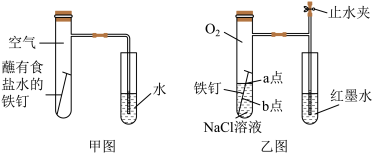
A.用纯氧气代替试管内空气 B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末 D.换成更细的导管,水中滴加红墨水
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐______ (填“加快”、“不变”、“减慢”),你认为影响因素为_______ 。
(3)为探究铁钉腐蚀实验 a、b 两点所发生的反应,进行以下实验,请完成表格空白:
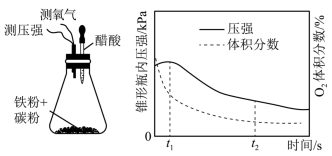
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化见图,从图中可分析,t1~t2之间主要发生_______ 腐蚀(填吸氧或析氢),原因_______ 。

(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,试写出该阳极电极反应式______ 。
II.已知草酸晶体(H2C2O4·XH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,三次结果如下:
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在______ (填“酸式”或“碱式”)滴定管中。
(2)到达滴定终点的标志是________ 。
(3)根据上述数据计算X=_______ 。
(4)误差分析(填偏高、偏低或无影响):若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值________ ;
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有

A.用纯氧气代替试管内空气 B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末 D.换成更细的导管,水中滴加红墨水
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐
| 时间/min | 1 | 3 | 5 | 7 | 9 |
| 液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
(3)为探究铁钉腐蚀实验 a、b 两点所发生的反应,进行以下实验,请完成表格空白:
| 实验操作 | 实验现象 | 实验结论 |
| 向NaCl溶液中滴加2~3滴酚酞指示剂 | a点附近溶液出现红色 | a点电极反应为 |
| 然后再滴加2~3滴铁氰化钾溶液 | b点周围出现蓝色沉淀 | b点电极反应为 Fe -2e-=Fe2+ |
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化见图,从图中可分析,t1~t2之间主要发生

(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,试写出该阳极电极反应式
II.已知草酸晶体(H2C2O4·XH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,三次结果如下:
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
| 标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在
(2)到达滴定终点的标志是
(3)根据上述数据计算X=
(4)误差分析(填偏高、偏低或无影响):若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值
研究金属腐蚀和防腐的原理很有现实意义.
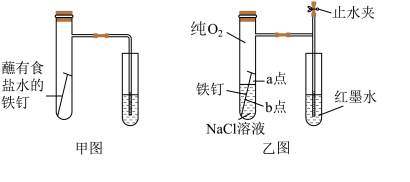
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置,某兴趣小组按装置试验,导管中液柱的上升缓慢,为更快更清晰地观察到液柱上升的现象,下列措施错误的________ (填序号)
A.用纯氧气代替试管内空气
B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末
D.换成更细的导管,水中滴加红墨水
(2)为探究铁钉腐蚀实验a、b两点所发生的反应,张老师进行以下实验,证明铁发生电化学腐蚀。请完成表格空白:
(3)孔老师认为仅通过b中现象不能证明铁发生了电化学腐蚀,补充进行下列实验,在实验几分钟后的记录如下:
以上实验表明,K3[Fe(CN)6]具有________ 性
(4)赵老师设计下面装置研究弱酸性环境中腐蚀的主要形式,测定锥形瓶内气压和空气中氧气的体积分数随时间变化见图,从图中可分析,t1~t2之间主要发生_________ 腐蚀(填吸氧或析氢)
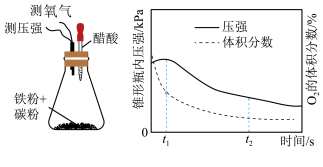
(5)金属阳极钝化形成保护膜是一种电化学防腐方法,将Fe作阳极置于H2SO4溶液中,一定条件下Fe表面形成致密Fe3O4氧化膜,试写出该阳极电极反应式_________ 。

(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置,某兴趣小组按装置试验,导管中液柱的上升缓慢,为更快更清晰地观察到液柱上升的现象,下列措施错误的
A.用纯氧气代替试管内空气
B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末
D.换成更细的导管,水中滴加红墨水
(2)为探究铁钉腐蚀实验a、b两点所发生的反应,张老师进行以下实验,证明铁发生电化学腐蚀。请完成表格空白:
| 实验操作 | 实验现象 | 实验结论 |
| ⅰ.向NaCl溶液中滴加2~3滴酚酞指示剂 | a点附近溶液出现红色 | a点电极反应为 |
| ⅱ.然后再滴加2~3滴铁氰化钾溶液 | b点周围出现蓝色沉淀 | b点电极反应为 沉淀的化学式为 |
(3)孔老师认为仅通过b中现象不能证明铁发生了电化学腐蚀,补充进行下列实验,在实验几分钟后的记录如下:
| 实验 | 滴管 | 现象 |
 1.0 mol·L-1NaCl溶液 | 0.5 mol•L﹣1K3[Fe(CN)6]溶液 | 铁片表面产生大量蓝色沉淀 |
(4)赵老师设计下面装置研究弱酸性环境中腐蚀的主要形式,测定锥形瓶内气压和空气中氧气的体积分数随时间变化见图,从图中可分析,t1~t2之间主要发生

(5)金属阳极钝化形成保护膜是一种电化学防腐方法,将Fe作阳极置于H2SO4溶液中,一定条件下Fe表面形成致密Fe3O4氧化膜,试写出该阳极电极反应式
电化学原理在防止金属腐蚀、能最转换、物质合成、环境治理等方面应用广泛。研究金属腐蚀和防腐的原理很有现实意义。
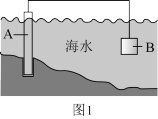
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择________ (填标号)。
A.碳棒 B.锌板 C.铜板
(2)某兴趣小组按图2装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有 (填序号)。
(3)该小组将图2装置改进成图3装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐________ (填“加快”“不变”或“减慢”),你认为影响因素为________ 。
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化见图,从图中可分析,t1~t2之间主要发生________ 腐蚀(填“吸氧”或“析氢”),原因________ 。
(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,试写出该阳极电极反应式_____________ 。


(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择
A.碳棒 B.锌板 C.铜板
(2)某兴趣小组按图2装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有 (填序号)。
| A.用纯氧气代替试管内空气 | B.用酒精灯加热试管提高温度 |
| C.将铁钉换成铁粉和炭粉混合粉末 | D.换成更细的导管,水中滴加红墨水 |
| 时间/min | 1 | 3 | 5 | 7 | 9 |
| 液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化见图,从图中可分析,t1~t2之间主要发生

(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,试写出该阳极电极反应式
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


