解答题-原理综合题 适中0.65 引用1 组卷54
回答下列问题:
Ⅰ.我国力争于2030年前做到“碳达峰”,2060年前实现“碳中和”。二氧化碳加氢制备甲醇既可以实现二氧化碳的转化利用,又可以有效缓解温室效应问题。
已知:反应①:
反应②:
反应③:
(1)原料CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为CO2捕获剂的是___________。(填标号)。
(2)平衡常数之间的关系为表示K3=___________ (用K1和K2表示)
Ⅱ.脱硝技术、含氮燃料是新的发展方向和研究热点,有着广泛的应用前景。
(3)在新型催化剂条件下NH3与NO和NO2(其中V(NO):V(NO2)=1:1)的混合气体反应生成N2,当生成1 mol N2时,转移的电子为___________ mol。
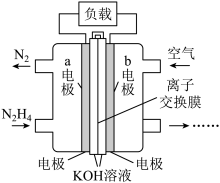
(4)肼(N2H4)可以用作燃料电池的原料。肼的电子式为___________ ;一种以液态肼为燃料的电池装置如图所示。b电极是___________ 极(填“正”或“负”),a电极的电极反应式为___________ 。
(5)用KMnO4也可高效脱除烟气中的NO,NO被氧化为 ,碱性条件下
,碱性条件下 被还原为
被还原为 。该反应的离子方程式为
。该反应的离子方程式为___________ 。
(6)实验室中利用KMnO4进行如下实验(假设每步反应完全进行),下列说法错误的是___________。

Ⅰ.我国力争于2030年前做到“碳达峰”,2060年前实现“碳中和”。二氧化碳加氢制备甲醇既可以实现二氧化碳的转化利用,又可以有效缓解温室效应问题。
已知:反应①:
反应②:
反应③:
(1)原料CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为CO2捕获剂的是___________。(填标号)。
| A.NaOH溶液 | B.浓氨水 | C.生石灰 | D.NH4Cl溶液 |
Ⅱ.脱硝技术、含氮燃料是新的发展方向和研究热点,有着广泛的应用前景。
(3)在新型催化剂条件下NH3与NO和NO2(其中V(NO):V(NO2)=1:1)的混合气体反应生成N2,当生成1 mol N2时,转移的电子为
(4)肼(N2H4)可以用作燃料电池的原料。肼的电子式为

(5)用KMnO4也可高效脱除烟气中的NO,NO被氧化为
(6)实验室中利用KMnO4进行如下实验(假设每步反应完全进行),下列说法错误的是___________。

| A.G与H均为氧化产物 | B.实验中KMnO4只作氧化剂 |
| C.Mn元素参与了3个氧化还原反应 | D.G与H的物质的量之和可能为0.25 mol |
21-22高三上·湖北十堰·阶段练习
类题推荐
我国力争于2030年前做到碳达峰,2060年前实现碳中和。二氧化碳加氢制备甲醇既可以实现二氧化碳的转化利用,又可以有效缓解温室效应问题。
已知:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

(1)原料 可通过捕获技术从空气或工业尾气中获取,下列物质能作为
可通过捕获技术从空气或工业尾气中获取,下列物质能作为 捕获剂的是___________(填标号)。
捕获剂的是___________(填标号)。
(2)根据盖斯定律,反应Ⅲ的
___________  。
。
(3)为提高单位时间内 的产量,可采取的措施有
的产量,可采取的措施有___________ 。(任填2项)
(4)上述反应平衡常数的自然对数 随
随 (T表示温度)的变化如图所示:
(T表示温度)的变化如图所示:

①反应Ⅰ、Ⅱ、Ⅲ中属于吸热反应的是___________ ,写出推理过程___________ 。
②若图中A点时发生反应 ,则该反应此时的
,则该反应此时的
___________ (填数值)。
(5)一定条件下,向体积为VL的恒容密闭容器中通入1mol 和3mol
和3mol  发生反应Ⅰ和Ⅲ,达到平衡时,容器中
发生反应Ⅰ和Ⅲ,达到平衡时,容器中 (g)为a mol,CO为b mol,此时
(g)为a mol,CO为b mol,此时 的浓度为
的浓度为___________  (用含a、b、V的代数式表示)。
(用含a、b、V的代数式表示)。
已知:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
(1)原料
| A.NaOH溶液 | B.浓氨水 | C. | D. |
(3)为提高单位时间内
(4)上述反应平衡常数的自然对数

①反应Ⅰ、Ⅱ、Ⅲ中属于吸热反应的是
②若图中A点时发生反应
(5)一定条件下,向体积为VL的恒容密闭容器中通入1mol
我国力争于 2030 年前做到碳达峰,2060 年前实现碳中和。二氧化碳加氢制备甲醇既可以实现二氧化碳的转化利用,又可以有效缓解温室效应问题。
已知:反应 I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=akJ·mol-1
反应 II:CO(g)+2H2(g)=CH3OH(g) ΔH2=b kJ·mol-1
反应III:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3
(1)原料 CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为 CO2 捕获剂的是_______(填标号)。
(2)根据盖斯定律,反应 III 的ΔH3=_______ kJ·mol-1
(3)对于上述 CO2加氢合成 CH3OH 的体系,下列说法错误的是_______(填标号)。
(4)上述反应平衡常数的自然对数 ln Kp(Kp是以分压表示的平衡常数,分压=总压×物质的量分数)随温度的变化如图所示:
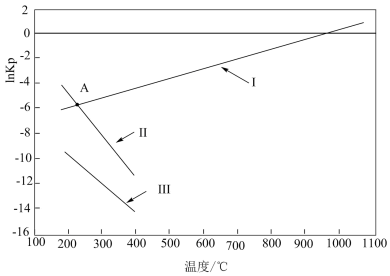
①反应I、II、III 中属于吸热反应的是_______ ,写出推理过程_______ 。
②若图中 A 点时发生反应 CH3OH(g)+CO2(g) ⇌2CO(g)+H2(g)+H2O(g),则lnKp=_______ (填数值)。
③若T0℃时,在密闭容器中加入 6 mol H2、4 molCO2只进行反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),维持压强为 p0kPa不变,达到平衡时H2的转化率是50%,则该温度下反应的平衡常数Kp=_______ 。
已知:反应 I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=akJ·mol-1
反应 II:CO(g)+2H2(g)=CH3OH(g) ΔH2=b kJ·mol-1
反应III:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3
(1)原料 CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为 CO2 捕获剂的是_______(填标号)。
| A.NaOH 溶液 | B.浓氨水 | C.CH3CH2OH | D.NH4Cl 溶液 |
(3)对于上述 CO2加氢合成 CH3OH 的体系,下列说法错误的是_______(填标号)。
| A.增大 H2浓度有利于提高 CO2的转化率 |
| B.若气体的平均相对分子质量保持不变,说明反应体系已达平衡 |
| C.体系达平衡后,若压缩体积,则反应 I 平衡不移动,反应 III 平衡逆向移动 |
| D.选用合适的催化剂可以提高 CH3OH 在单位时间内的产量 |

①反应I、II、III 中属于吸热反应的是
②若图中 A 点时发生反应 CH3OH(g)+CO2(g) ⇌2CO(g)+H2(g)+H2O(g),则lnKp=
③若T0℃时,在密闭容器中加入 6 mol H2、4 molCO2只进行反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),维持压强为 p0kPa不变,达到平衡时H2的转化率是50%,则该温度下反应的平衡常数Kp=
我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.

Ⅱ.

回答下列问题:
(1)已知
 ,请计算
,请计算
_______ 。
(2)在恒温恒容的容器中发生上述反应,下列说法正确的有_______。
(3)研究表明:其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性。使用该催化剂,将1molCO2和2.44molH2在1L密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:
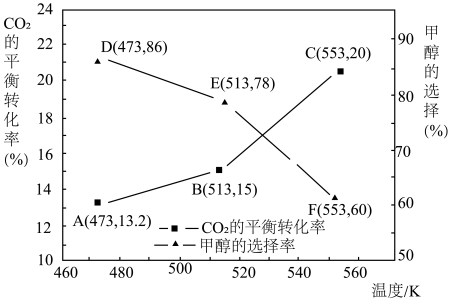
①温度为553K,经10min体系达到平衡,则CO2的平均反应速率为_______ 。
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,分析其原因_______ 。
(4)以某甲醇燃料电池为电源,回收普通干电池中锌与MnO2,其工作原理如图所示,质子交换膜左右两侧的溶液均为1L2mol/LH2SO4溶液。
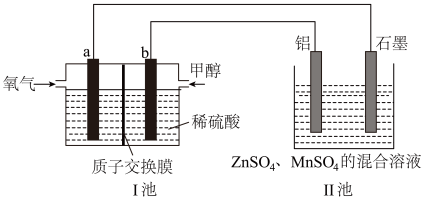
①通入甲醇的电极反应式为_______ ,a电极和石墨电极的电子流向为_______ ,(填“a到石墨”或“石墨到a”),当导线中有2mole-发生转移时,I池的左右两侧溶液的质量差为_______ g(假设反应物耗尽,忽略气体的溶解)。
②II池中回收锌与MnO2的总反应的离子方程式为_______ 。
③若燃料电池中负极消耗4.8g甲醇,且均完全转化为电能,电解池中回收制得19.5g单质Zn,该装置的电流效率η=_______ 。(保留2位小数)(η= ×100%)
×100%)
Ⅰ.
Ⅱ.
回答下列问题:
(1)已知
(2)在恒温恒容的容器中发生上述反应,下列说法正确的有_______。
| A.气体平均摩尔质量保持不变,反应体系已达平衡 |
| B.加入催化剂,可提高CO2的平衡转化率 |
| C.平衡后缩小体积增大体系压强,有利于提高CH3OH产率 |
| D.平衡后升高温度,反应Ⅱ的正反应速率增大、逆反应速率减小,平衡正移 |

①温度为553K,经10min体系达到平衡,则CO2的平均反应速率为
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,分析其原因
(4)以某甲醇燃料电池为电源,回收普通干电池中锌与MnO2,其工作原理如图所示,质子交换膜左右两侧的溶液均为1L2mol/LH2SO4溶液。

①通入甲醇的电极反应式为
②II池中回收锌与MnO2的总反应的离子方程式为
③若燃料电池中负极消耗4.8g甲醇,且均完全转化为电能,电解池中回收制得19.5g单质Zn,该装置的电流效率η=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


