解答题-原理综合题 较难0.4 引用2 组卷142
氢是人们公认的清洁能源,作为零碳能源正在脱颖而出,氢的获得及以氢为原料的工业生产工艺成为科技工作者研究的重要课题。
(1)工业生产中可利用 还原
还原 制备清洁能源甲醇。
制备清洁能源甲醇。
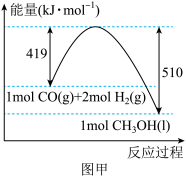
①已知 和
和 的燃烧热(
的燃烧热( )分别为
)分别为 、
、 。
。 与
与 合成甲醇的能量变化如图甲所示,则用
合成甲醇的能量变化如图甲所示,则用 和
和 制备甲醇和液态水的热化学方程式为
制备甲醇和液态水的热化学方程式为___________ 。
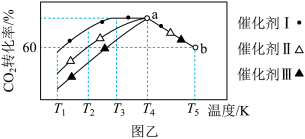
②将一定量的 和
和 充入某恒容密闭容器中,测得在不同催化剂作用下,相同时间内
充入某恒容密闭容器中,测得在不同催化剂作用下,相同时间内 的转化率与温度的变化如图乙所示,催化效果最好的是催化剂
的转化率与温度的变化如图乙所示,催化效果最好的是催化剂___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”);该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是___________ 。
(2)利用 和水蒸气可生产
和水蒸气可生产 ,反应的化学方程式为
,反应的化学方程式为 。将不同量的
。将不同量的 和
和 分别通入体积为2L的恒容密闭容器中进行上述反应,得到数据如下表所示
分别通入体积为2L的恒容密闭容器中进行上述反应,得到数据如下表所示
①该反应的正反应为___________ 反应(填“放热”或“吸热”)。
②900℃时,从开始到达到平衡时的反应速率
___________ (保留2位小数),达到平衡时
___________ 。
(3)利用废弃的 的热分解可生产
的热分解可生产 :
: 。现将
。现将 通入某恒压(压强
通入某恒压(压强 )密闭容器中,在不同温度下测得
)密闭容器中,在不同温度下测得 的平衡转化率如图所示。
的平衡转化率如图所示。
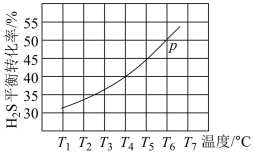
已知:对于气相反应,用某组分(B)的平衡压强 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数。温度为
也可表示平衡常数。温度为 ℃时,该反应的平衡常数
℃时,该反应的平衡常数
___________  (用a的代数式表示)。
(用a的代数式表示)。
(1)工业生产中可利用
①已知

②将一定量的

(2)利用
| 温度/℃ | 起始量 | 达到平衡 | |||
| 时间/min | |||||
| 650 | 4 | 2 | 1.6 | 6 | |
| 900 | 3 | 2 | 3 | ||
②900℃时,从开始到达到平衡时的反应速率
(3)利用废弃的

已知:对于气相反应,用某组分(B)的平衡压强
21-22高三上·湖北十堰·阶段练习
类题推荐
以氢为原料的工业生产工艺及氢的获得是科技工作者研究的重要课题。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
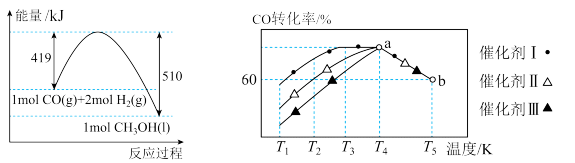
①已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJ·mol-1、-285.8kJ·mol-1。由H2和CO生成甲醇的热化学方程式为:2H2(g)+CO(g)= CH3OH(1)的△H=-91kJ·mol-1。则3H2(g)+CO2(g)=CH3OH(1)+H2O(1)的△H=____________ kJ·mol-1。
②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率如图甲所示。
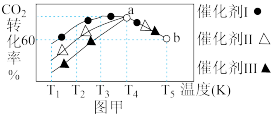
该反应在a点达到平衡状态,a点转化率比b点的高,其原因是____________ 。
(2)利用CO和H2O生产H2:CO(g)+H2O(g) ⇌ CO2(g)+H2(g)。将不同配比的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中。有关数据如下表:
①该反应的正反应为________ 反应(填“吸热”、“放热”)。
②650℃时,下列叙述说明达到化学平衡状态的是_____ (填标号)
a.v(CO):v(H2O):v(H2):v(CO2)=1:1:1:1
b.生成n mol CO2(g)的同时生成n mol H2O(g)
c.n mol CO断裂的同时断裂2n mol H—H
d.某时刻,n(CO):n(H2O):n(CO2):n(H2)=6:1:4:4
③900℃时,达平衡时v(H2O)=_______ mol·L-1·min-1。(结果保留两位有效数字)
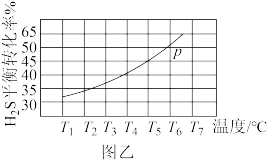
(3)利用工业废气中的H2S热分解制H2:2H2S(g) ⇌ 2H2(g)+S2(g)。现将0.2molH2S(g)通入某恒压密闭容器中,起始压强p0=aMPa,在不同温度下测得H2S的平衡转化率如图乙所示,则T6℃时,该反应的Kp=________ (用含a的代数式表示)。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJ·mol-1、-285.8kJ·mol-1。由H2和CO生成甲醇的热化学方程式为:2H2(g)+CO(g)= CH3OH(1)的△H=-91kJ·mol-1。则3H2(g)+CO2(g)=CH3OH(1)+H2O(1)的△H=
②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率如图甲所示。

该反应在a点达到平衡状态,a点转化率比b点的高,其原因是
(2)利用CO和H2O生产H2:CO(g)+H2O(g) ⇌ CO2(g)+H2(g)。将不同配比的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中。有关数据如下表:
| 温度/ | 起始量 | 平衡数据 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 时间/min | |
| 650 | 4 | 2 | 1.6 | 6 | |
| 900 | 3 | 2 | 33.3% | 3 | |
①该反应的正反应为
②650℃时,下列叙述说明达到化学平衡状态的是
a.v(CO):v(H2O):v(H2):v(CO2)=1:1:1:1
b.生成n mol CO2(g)的同时生成n mol H2O(g)
c.n mol CO断裂的同时断裂2n mol H—H
d.某时刻,n(CO):n(H2O):n(CO2):n(H2)=6:1:4:4
③900℃时,达平衡时v(H2O)=
(3)利用工业废气中的H2S热分解制H2:2H2S(g) ⇌ 2H2(g)+S2(g)。现将0.2molH2S(g)通入某恒压密闭容器中,起始压强p0=aMPa,在不同温度下测得H2S的平衡转化率如图乙所示,则T6℃时,该反应的Kp=

回答下列问题
(1)已知CO与 合成甲醇的能量变化如图所示,将一定量的CO和
合成甲醇的能量变化如图所示,将一定量的CO和 充入某恒容密闭容器中发生上述反应,测得在不同催化剂作用下,相同时间内CO的转化率与温度的关系如图所示。催化效果最好的催化剂是
充入某恒容密闭容器中发生上述反应,测得在不同催化剂作用下,相同时间内CO的转化率与温度的关系如图所示。催化效果最好的催化剂是_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”),该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是_______ 。
(2)利用CO和水蒸气可制备 ,反应的化学方程式为
,反应的化学方程式为 。将不同量的CO(g)和
。将不同量的CO(g)和 分别通入容积为2L的恒容密闭容器中进行上述反应,得到的三组数据如下表所示:
分别通入容积为2L的恒容密闭容器中进行上述反应,得到的三组数据如下表所示:
①该反应的正反应为_______ (填“放热”或“吸热”)反应。
②900℃时,0~3min内反应的平均速率
_______ ,达到平衡时
_______ 。(保留2位小数)
(3)丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等。以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,反应为 。一定温度下,在容积为VL的恒容密闭容器中充入
。一定温度下,在容积为VL的恒容密闭容器中充入 和
和 发生上述反应。tmin时达到平衡状态,此时容器中
发生上述反应。tmin时达到平衡状态,此时容器中 ,
, ,
, ,且
,且 占平衡总体积的
占平衡总体积的 ,该时间段内的反应速率
,该时间段内的反应速率
_______  (用含a、V、t的式子表示)。
(用含a、V、t的式子表示)。
(1)已知CO与

(2)利用CO和水蒸气可制备
| 温度/℃ | 起始量 | 达到平衡 | |||
| n(CO)/mol | CO转化率 | 时间/min | |||
| 650 | 4 | 2 | 1.6 | 6 | |
| 900 | 3 | 2 | 3 | ||
②900℃时,0~3min内反应的平均速率
(3)丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等。以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,反应为
近年科学家提出“绿色自由”构想。把空气中的CO2进行转化,并使之与H2反应生成可再生能源甲醇。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①下列关于氢能的说法正确的是____ 。
A.氢能是清洁能源 B.氢能是二次能源
C.氢能是不可再生能源 D.气态氢能源更容易保存和运输
②已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJ•mol-1、-285.8kJ•mol-1。CO与H2合成甲醇的能量变化如图甲所示:

则用CO2(g)和H2(g)制备液态甲醇的热化学方程式为____ 。
③将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示:催化效果最好的是催化剂____ (选填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g)⇌CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应,得到三组数据如表所示:
900℃时,达到平衡时的反应速率v(H2O)=____ 。(保留2位小数)。
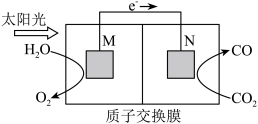
(3)科学家还研究了其他转化温室气体的方法,利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为____ 。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①下列关于氢能的说法正确的是
A.氢能是清洁能源 B.氢能是二次能源
C.氢能是不可再生能源 D.气态氢能源更容易保存和运输
②已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJ•mol-1、-285.8kJ•mol-1。CO与H2合成甲醇的能量变化如图甲所示:

则用CO2(g)和H2(g)制备液态甲醇的热化学方程式为
③将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示:催化效果最好的是催化剂
(2)利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g)⇌CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应,得到三组数据如表所示:
| 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 时间/min | |
| 650 | 4 | 2 | 1.6 | 10 | |
| 900 | 3 | 2 | 5 | ||
(3)科学家还研究了其他转化温室气体的方法,利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


