解答题-原理综合题 适中0.65 引用1 组卷98
在298K时,研究CO2氧化C2H6制C2H4对资源综合利用有重要意义。相关的主要化学反应有:
Ⅰ、C2H6(g) C2H4(g)+H2(g)ΔH1=+136kJ·mol-1
C2H4(g)+H2(g)ΔH1=+136kJ·mol-1
Ⅱ、C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g)ΔH2=+177kJ·mol-1
C2H4(g)+H2O(g)+CO(g)ΔH2=+177kJ·mol-1
Ⅲ、C2H6(g)+2CO2(g) 4CO(g)+3H2(g)ΔH3=+430kJ·mol-1
4CO(g)+3H2(g)ΔH3=+430kJ·mol-1
Ⅳ、CO2(g)+H2(g) CO(g)+H2O(g)ΔH4
CO(g)+H2O(g)ΔH4
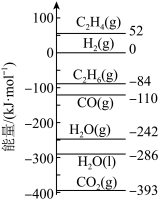
已知:298K时,相关物质的相对能量如图1所示。根据以上信息和数据进行回答下列问题。
(1)①根据相关物质的相对能量计算ΔH4=___________ kJ·mol-1。
②下列描述正确的是___________ (填字母)。
A.升高温度反应Ⅰ的反应速率和平衡常数均增大
B.反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
C.恒温恒压下通入惰性气体,反应Ⅰ的平衡正向移动
D.反应Ⅳ中当压强恒定不变时,该反应达到平衡状态
E.以上四个反应中,ΔH不变时,以上反应均达到平衡状态
(2)CO2和C2H6按物质的量1∶1投料,在923K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如表:
结合具体反应分析,在催化剂X作用下,CO2氧化C2H6的主要产物是___________ ,判断依据是___________ 。
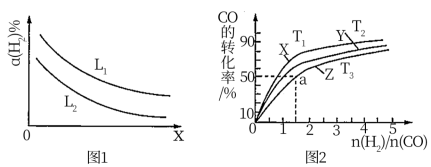
(3)H2可以用碳和水蒸气反应制取,反应的热化学方程式为C(s)+H2O(g) CO(g)+H2(g)ΔH>0。一定条件下达到平衡时,温度、压强对H2产率的影响如图1所示。
CO(g)+H2(g)ΔH>0。一定条件下达到平衡时,温度、压强对H2产率的影响如图1所示。
①X表示___________ (填“温度”或“压强”),L1___________ L2(填“>”“<”或“=”)。
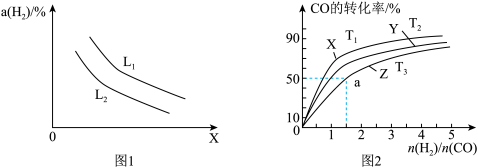
②已知CO与H2能合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。在恒压容器中,曲线X、Y、Z分别表示在T1、T2、T3三种温度下合成甲醇气体的过程,控制不同的原料投料比,CO的平衡转化率如图2所示:若温度为T3时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=3:2,则该反应的压强平衡常数KP的计算式为
CH3OH(g)。在恒压容器中,曲线X、Y、Z分别表示在T1、T2、T3三种温度下合成甲醇气体的过程,控制不同的原料投料比,CO的平衡转化率如图2所示:若温度为T3时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=3:2,则该反应的压强平衡常数KP的计算式为___________ 。(KP表示生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压=总压强×该物质的物质的量分数)。

Ⅰ、C2H6(g)
Ⅱ、C2H6(g)+CO2(g)
Ⅲ、C2H6(g)+2CO2(g)
Ⅳ、CO2(g)+H2(g)
已知:298K时,相关物质的相对能量如图1所示。根据以上信息和数据进行回答下列问题。
(1)①根据相关物质的相对能量计算ΔH4=
②下列描述正确的是
A.升高温度反应Ⅰ的反应速率和平衡常数均增大
B.反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
C.恒温恒压下通入惰性气体,反应Ⅰ的平衡正向移动
D.反应Ⅳ中当压强恒定不变时,该反应达到平衡状态
E.以上四个反应中,ΔH不变时,以上反应均达到平衡状态
(2)CO2和C2H6按物质的量1∶1投料,在923K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如表:
| 催化剂 | 转化率C2H6/% | 转化率CO2/% | 产率C2H4/% |
| 催化剂X | 19.0 | 37.6 | 3.3 |
结合具体反应分析,在催化剂X作用下,CO2氧化C2H6的主要产物是
(3)H2可以用碳和水蒸气反应制取,反应的热化学方程式为C(s)+H2O(g)

①X表示
②已知CO与H2能合成甲醇,反应方程式为CO(g)+2H2(g)
20-21高三下·贵州遵义·阶段练习
类题推荐
研究CO2氧化C2H6制C2H4对资源综合利用有重要意义。
相关的主要化学反应有:
Ⅰ.C2H6(g)=C2H4(g)+H2(g) ΔH1=136 kJ·mol−1
Ⅱ.C2H6(g)+CO2(g)=C2H4(g)+H2O(g)+CO(g) ΔH2=177 kJ·mol−1
Ⅲ.C2H6(g)+2CO2(g)=4CO(g)+3H2(g) ΔH3
Ⅳ.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH4=41 kJ·mol−1
已知:298K时,相关物质的相对能量(如图)。可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。
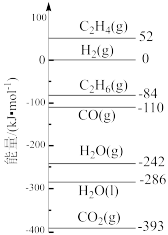
例如:H2O(g)=H2O(l) ΔH4=(−286 kJ·mol−1)-(−242 kJ·mol−1)=−44 kJ·mol−1。
请回答:
(1)①根据相关物质的相对能量计算ΔH3=___________ kJ·mol−1。
②下列描述正确的是___________ 。
A.升高温度反应Ⅰ的平衡常数增大
B.加压有利于反应Ⅰ、Ⅱ的平衡正向移动
C.反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
D.恒温恒压下通水蒸气,反应Ⅳ的平衡逆向移动
(2)①CO2和C2H6按物质的量1∶1投料,在923 K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如下表:
结合具体反应分析,在催化剂X作用下,CO2氧化C2H6的主要产物是___________ (填化学式),判断依据是___________ 。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高C2H4的选择性(生成C2H4的物质的量与消耗C2H6的物质的量之比)。在773 K,乙烷平衡转化率为9.1%,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到11.0%。结合具体反应说明乙烷转化率增大的原因是___________ 。
相关的主要化学反应有:
Ⅰ.C2H6(g)=C2H4(g)+H2(g) ΔH1=136 kJ·mol−1
Ⅱ.C2H6(g)+CO2(g)=C2H4(g)+H2O(g)+CO(g) ΔH2=177 kJ·mol−1
Ⅲ.C2H6(g)+2CO2(g)=4CO(g)+3H2(g) ΔH3
Ⅳ.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH4=41 kJ·mol−1
已知:298K时,相关物质的相对能量(如图)。可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。

例如:H2O(g)=H2O(l) ΔH4=(−286 kJ·mol−1)-(−242 kJ·mol−1)=−44 kJ·mol−1。
请回答:
(1)①根据相关物质的相对能量计算ΔH3=
②下列描述正确的是
A.升高温度反应Ⅰ的平衡常数增大
B.加压有利于反应Ⅰ、Ⅱ的平衡正向移动
C.反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
D.恒温恒压下通水蒸气,反应Ⅳ的平衡逆向移动
(2)①CO2和C2H6按物质的量1∶1投料,在923 K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如下表:
| 催化剂 | 转化率C2H6/% | 转化率CO2/% | 产率C2H4/% |
| 催化剂X | 19.0 | 37.6 | 3.3 |
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高C2H4的选择性(生成C2H4的物质的量与消耗C2H6的物质的量之比)。在773 K,乙烷平衡转化率为9.1%,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到11.0%。结合具体反应说明乙烷转化率增大的原因是
Ⅰ.从氯二氟甲烷(CHClF2)中获得四氟乙烯(C2F4): 。
。 样品在18.5L容器内加热。反应达到平衡后,平衡混合物中含有
样品在18.5L容器内加热。反应达到平衡后,平衡混合物中含有 。
。
(1)写出四氟乙烯形成的高分子化合物聚四氟乙烯的结构简式_______ 。
(2)如图是一定条件下,反应物平衡时物质的量分数与压强的关系曲线。据此判断 的状态是
的状态是 _______ (填“气体”、“液体”或“固体”)。
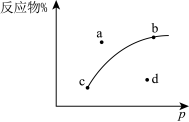
(3)该反应在_______ (填“高温”、“低温”或“任意温度”)的自发性更大;
(4)如图的a~d四点中,表示Q>K的点有_______ ;
(5)以平衡时气态物质的量分数表示平衡常数 ,其计算表达式为
,其计算表达式为 _______ 。
Ⅱ. 研究 氧化
氧化 制
制 对资源综合利用有重要意义。相关的主要化学反应有(298K时,相关物质的相对能量如图):
对资源综合利用有重要意义。相关的主要化学反应有(298K时,相关物质的相对能量如图):
Ⅰ.C2H6(g) C2H4(g)+H2(g) △H1=136kJ·mol-1
C2H4(g)+H2(g) △H1=136kJ·mol-1
Ⅱ.C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g) △H2=177kJ·mol-1
C2H4(g)+H2O(g)+CO(g) △H2=177kJ·mol-1
Ⅲ.C2H6(g)+2CO2(g) 4CO(g)+3H2(g) △H3
4CO(g)+3H2(g) △H3
Ⅳ.CO2(g)+H2(g) CO(g)+H2O(g) △H4=41kJ·mol-1
CO(g)+H2O(g) △H4=41kJ·mol-1

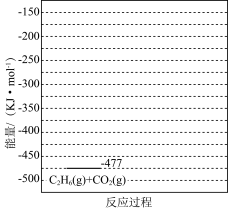
(6)有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:[C2H6(g)+CO2(g)]→[C2H4(g)+H2(g)+CO2(g)]→[C2H4(g)+CO(g)+H2O(g)],且第二步速率较慢(反应活化能为 )。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量−反应过程图”,起点从[C2H6(g)+CO2(g)]的能量
)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量−反应过程图”,起点从[C2H6(g)+CO2(g)]的能量 开始(如图)。
开始(如图)。_______
(7)① 和
和 按物质的量1:1投料,在923K和保持总压恒定的条件下,研究催化剂X对“
按物质的量1:1投料,在923K和保持总压恒定的条件下,研究催化剂X对“ 氧化
氧化 制
制 ”的影响,所得实验数据如下表:
”的影响,所得实验数据如下表:
结合具体反应分析,在催化剂X作用下, 氧化
氧化 的主要产物是
的主要产物是_______ ,判断依据是_______ 。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高 的选择性(生成
的选择性(生成 的物质的量与消耗
的物质的量与消耗 的物质的量之比)。在773K,乙烷平衡转化率为9.1%,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到11.0%。结合具体反应说明乙烷转化率增大的原因是
的物质的量之比)。在773K,乙烷平衡转化率为9.1%,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到11.0%。结合具体反应说明乙烷转化率增大的原因是_______ 。
(1)写出四氟乙烯形成的高分子化合物聚四氟乙烯的结构简式
(2)如图是一定条件下,反应物平衡时物质的量分数与压强的关系曲线。据此判断

(3)该反应在
(4)如图的a~d四点中,表示Q>K的点有
(5)以平衡时气态物质的量分数表示平衡常数
Ⅱ. 研究
Ⅰ.C2H6(g)
Ⅱ.C2H6(g)+CO2(g)
Ⅲ.C2H6(g)+2CO2(g)
Ⅳ.CO2(g)+H2(g)

(6)有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:[C2H6(g)+CO2(g)]→[C2H4(g)+H2(g)+CO2(g)]→[C2H4(g)+CO(g)+H2O(g)],且第二步速率较慢(反应活化能为

(7)①
| 催化剂 | 转化率C2H6/% | 转化率CO2/% | 产率C2H4/% |
| 催化剂X | 19.0 | 37.6 | 3.3 |
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网