解答题-实验探究题 较难0.4 引用1 组卷368
高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定;Fe3+ 遇KSCN溶液显红色。
(1)制备K2FeO4。
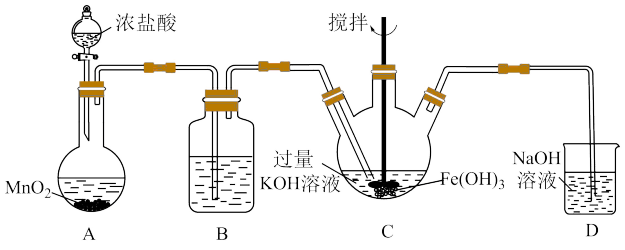
①C为制备K2FeO4装置,KOH溶液过量的原因是_______ 。
②D为尾气处理装置,发生反应的离子方程式为_______ 。
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
①由方案I中溶液变红可知a中含有_______ 。该离子的产生_______ (填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ得出氧化性:Cl2_______  (填“>”或“<”)
(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下,配平及完成上述离子方程式_______ 。
_______ +_______H+=_______O2↑+_______ Fe3++_______
+_______H+=_______O2↑+_______ Fe3++_______
现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为_______ 。(计算结果保留到0.1%)
(1)制备K2FeO4。

①C为制备K2FeO4装置,KOH溶液过量的原因是
②D为尾气处理装置,发生反应的离子方程式为
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,有Cl2产生。 |
②方案Ⅱ得出氧化性:Cl2
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下,配平及完成上述离子方程式
_______
现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为
21-22高一上·江西宜春·期中
类题推荐
高铁酸钾(K2FeO4)是一种新型、高效、无毒的多功能水处理剂。K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定;Fe3+遇KSCN溶液显红色。
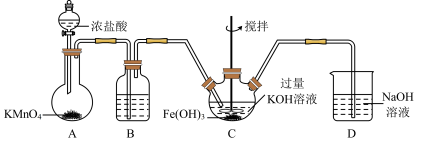
(1)制备K2FeO4。

①装浓盐酸的仪器名称是_____ 。
②请写出A中制备氯气的化学方程式:_____ ,D中的离子方程试:____ 。
③B中装的药品是____ 。
④C中,氯气先与KOH反应生成次氯酸钾,次氯酸钾再与氢氧化铁和KOH反应生成高铁酸钾(K2FeO4),在该反应体系中,71g氯气完全反应后理论上最多可生成高铁酸钾_____ g。
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
①由方案I中溶液变红可知a中含有Fe3+,该离子的产生能否判断它是由K2FeO4被Cl-还原形成的,并说明理由?_____ 。
②使用时经常通过高铁酸钾与稀硫酸反应生成氧气的量来测高铁酸钾的纯度。请写出该测定过程中反应的离子方程式:_____ 。
(1)制备K2FeO4。

①装浓盐酸的仪器名称是
②请写出A中制备氯气的化学方程式:
③B中装的药品是
④C中,氯气先与KOH反应生成次氯酸钾,次氯酸钾再与氢氧化铁和KOH反应生成高铁酸钾(K2FeO4),在该反应体系中,71g氯气完全反应后理论上最多可生成高铁酸钾
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
②使用时经常通过高铁酸钾与稀硫酸反应生成氧气的量来测高铁酸钾的纯度。请写出该测定过程中反应的离子方程式:
高铁酸钾(K2FeO4)是一新型高效无毒的多功能水处理剂。资料:K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4
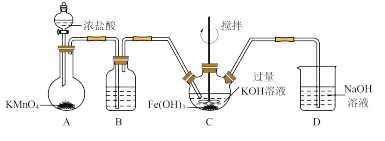
①写出A中发生反应的化学方程式______ 。
②除杂装置B中的试剂为____ 。
③C为制备K2FeO4装置,KOH溶液过量的原因是____ 。
④D为尾气处理装置,发生反应的离子方程式为____ 。
(2)探究K2FeO4的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl−而产生Cl2设计以下方案:
①由方案Ⅰ中溶液变红可知a中含有____ 。该离子的产生__ (填“能”或“不能”)判断一定是由K2FeO4被Cl−还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是____ ,方案Ⅱ得出氧化性:Cl2___ FeO42−(填“ ”或“
”或“ ”)。
”)。
(1)制备K2FeO4

①写出A中发生反应的化学方程式
②除杂装置B中的试剂为
③C为制备K2FeO4装置,KOH溶液过量的原因是
④D为尾气处理装置,发生反应的离子方程式为
(2)探究K2FeO4的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl−而产生Cl2设计以下方案:
| 方案Ⅰ | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生 |
①由方案Ⅰ中溶液变红可知a中含有
②方案Ⅱ用KOH溶液洗涤的目的是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网