单选题 较难0.4 引用1 组卷117
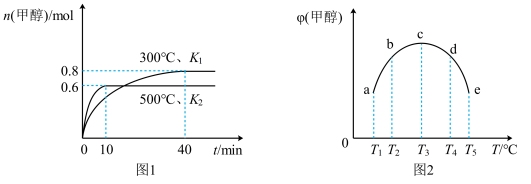
| A.该反应的 |
| B.将容器c中的平衡状态转变到容器 |
| C.300℃时,向平衡后的容器中再充入 |
| D.500℃时,向平衡后的容器中再充入 |
21-22高二下·四川内江·开学考试
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网

| A.该反应的 |
| B.将容器c中的平衡状态转变到容器 |
| C.300℃时,向平衡后的容器中再充入 |
| D.500℃时,向平衡后的容器中再充入 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网