解答题-原理综合题 较难0.4 引用1 组卷212
I.习总书记曾提出“绿水青山就是金山银山”的科学论断,研究二氧化碳的资源化利用具有重要的意义。请回答下列问题:
(1)已知下列热化学方程式:
①

②

则CO2与H2反应生成甲醇气体和水蒸气的热化学方程式为:_______ 。
(2)一定温度和压强为1MPa条件下,将 和
和 按物质的量之比为1∶4通入容积可变的密闭容器中发生反应,假设只发生反应:
按物质的量之比为1∶4通入容积可变的密闭容器中发生反应,假设只发生反应:
a. ;
;
b. ;
;
10min两个反应均达到平衡时,CO2平衡转化率为60%,CH4选择性为50%,[CH4的选择性 ]。该温度下,反应b的Kp=
]。该温度下,反应b的Kp=_______ (保留两位有效数字),已知Kp是用反应体系中气体物质的分压来表示的平衡常数,气体分压=总压×气体物质的量分数),用CH4的分压变化表示反应a在10分钟内达到平衡的平均速率为_______  (保留两位有效数字)。
(保留两位有效数字)。
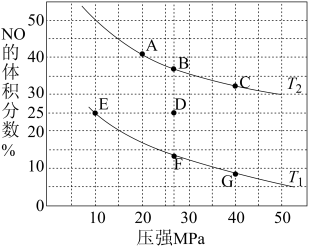
II.燃煤排放的烟气含有和NOx,形成酸雨、污染大气。采用化学吸收剂对烟气进行脱硫、脱硝,对环境保护有着重要的意义。回答下列问题:
(3)在不同温度下, 溶液脱硫、脱硝的反应中,
溶液脱硫、脱硝的反应中, 和NO的平衡分压
和NO的平衡分压 如图所示。
如图所示。
由图分析可知。反应温度升高,脱硫、脱硝反应的平衡常数均_______ (填“增大”“不变”或“减小”)。原因可能是_______ (写出一条原因即可)。
(4)以连二亚硫酸根 为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
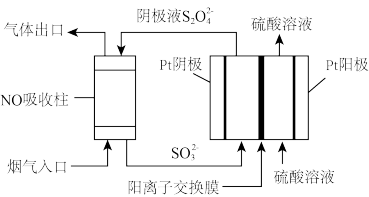
①阴极区的电极反应式为_______ 。
②NO吸收转化后的主要产物为N2,若通电时电路中转移了0.5mole—,则此通电过程中理论上吸收的NO在标准状况下的体积为_______ L。
(1)已知下列热化学方程式:
①
②
则CO2与H2反应生成甲醇气体和水蒸气的热化学方程式为:
(2)一定温度和压强为1MPa条件下,将
a.
b.
10min两个反应均达到平衡时,CO2平衡转化率为60%,CH4选择性为50%,[CH4的选择性
II.燃煤排放的烟气含有和NOx,形成酸雨、污染大气。采用化学吸收剂对烟气进行脱硫、脱硝,对环境保护有着重要的意义。回答下列问题:
(3)在不同温度下,

由图分析可知。反应温度升高,脱硫、脱硝反应的平衡常数均
(4)以连二亚硫酸根

①阴极区的电极反应式为
②NO吸收转化后的主要产物为N2,若通电时电路中转移了0.5mole—,则此通电过程中理论上吸收的NO在标准状况下的体积为
22-23高三上·湖北·开学考试
类题推荐
研究二氧化碳的资源化利用具有重要的意义。回答下列问题:
(1)已知下列热化学方程式:
反应I:
 。
。
反应II:

则反应 的
的
_______ 。
(2)在T℃时,将 和
和 加入容积不变的密闭容器中,发生反应I:
加入容积不变的密闭容器中,发生反应I: ,能判断反应达到平衡的是_______(填字母)。
,能判断反应达到平衡的是_______(填字母)。
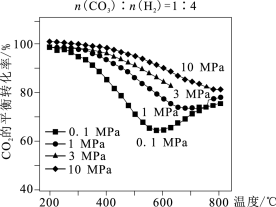
(3)将 的混合气体充入密闭容器中发生上述反应I、II,在不同温度和压强时,
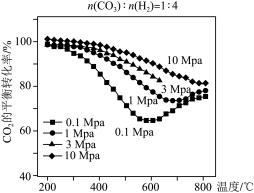
的混合气体充入密闭容器中发生上述反应I、II,在不同温度和压强时, 的平衡转化率如图所示。0.1MPa时,
的平衡转化率如图所示。0.1MPa时, 的转化率在600℃之后随温度升高而增大的主要原因是
的转化率在600℃之后随温度升高而增大的主要原因是____ 。
(4) 加氢制备
加氢制备 的一种催化机理如图,下列说法正确的是_______。
的一种催化机理如图,下列说法正确的是_______。

(5)一定温度和压强为1MPa条件下,将 和
和 按物质的量之比为1:4通入密闭弹性容器中发生催化反应,假设只发生反应:
按物质的量之比为1:4通入密闭弹性容器中发生催化反应,假设只发生反应:
I.
II.
10min时两个反应均达到平衡, 平衡转化率为80%,
平衡转化率为80%, 选择性为50%[
选择性为50%[ 的选择性
的选择性 ]。该温度下,反应II的
]。该温度下,反应II的
_______ (已知 是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替),用
是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替),用 的分压变化表示反应I在10分钟内达平衡的平均速率为
的分压变化表示反应I在10分钟内达平衡的平均速率为_______ (保留两位有效数字) 。
。
(1)已知下列热化学方程式:
反应I:
反应II:
则反应
(2)在T℃时,将
| A. |
| B.容器内气体压强不再发生变化 |
| C.混合气体的密度不再发生变 |
| D.混合气体的平均相对分子质量不再发生变化 |

(4)

| A.催化过程使用的催化剂为 |
| B. |
| C. |
| D. |
I.
II.
10min时两个反应均达到平衡,
研究碳及其化合物的资源化利用具有重要的意义。回答下列问题:
(1)已知下列热化学方程式:
反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1=-164.9kJ/mol。
CH4(g)+2H2O(g) ΔH1=-164.9kJ/mol。
反应II:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol
则反应CH4(g)+H2O(g) CO(g)+3H2(g)的ΔH3=
CO(g)+3H2(g)的ΔH3=___________ kJ/mol。
(2)能判断反应CO2(g)+4H2(g) CH4(g)+2H2O(g)达到平衡的是___________(填标号)。
CH4(g)+2H2O(g)达到平衡的是___________(填标号)。
(3)将n(CO2):n(H2)=1:4的混合气体充入密闭容器中发生上述反应I、II,在不同温度和压强时,CO2的平衡转化率如图。0.1MPa时,CO2的转化率在600°C之后,随温度升高而增大的主要原因是___________ 。 HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始
HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始 的关系如图所示:(分压=总压×物质的量分数)
的关系如图所示:(分压=总压×物质的量分数)___________ mol/(L·min)。
②b点时反应的平衡常数Kp=___________ (kPa)-1(以分压表示)。
③c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率___________ (填“增大”“不变”或“减小”)。
(5)氮的氧化物脱除可用电化学原理处理,如图装置可同时吸收 和NO。已知:
和NO。已知: 是一种弱酸。该装置中阴极的电极反应式为
是一种弱酸。该装置中阴极的电极反应式为___________ ,应选择___________ (填“阳”或“阴”)离子交换膜。
(1)已知下列热化学方程式:
反应I:CO2(g)+4H2(g)
反应II:CO2(g)+H2(g)
则反应CH4(g)+H2O(g)
(2)能判断反应CO2(g)+4H2(g)
| A.CO2的消耗速率和CH4的生成速率相等 |
| B.混合气体的密度不再发生变化 |
| C.容器内气体压强不再发生变化 |
| D.混合气体的平均相对分子质量不再发生变化 |
(3)将n(CO2):n(H2)=1:4的混合气体充入密闭容器中发生上述反应I、II,在不同温度和压强时,CO2的平衡转化率如图。0.1MPa时,CO2的转化率在600°C之后,随温度升高而增大的主要原因是
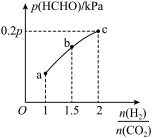
②b点时反应的平衡常数Kp=
③c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率
(5)氮的氧化物脱除可用电化学原理处理,如图装置可同时吸收
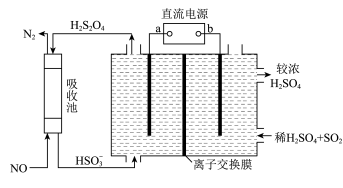
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网